本社:三重県津市大門7-15 津センターパレス4F
研究室:津市栗真町屋町1577 三重大学 総合研究棟2 A4F
TEL 059-253-8091 平日9:30〜18:00
E-mail info@ksk-lab.co.jp
お問い合わせフォーム→こちらをクリックしてください
- 機能性表示食品の特徴、費用、期間
- 機能性表示食品の届出(申請)に必要な書類と作業工程
- 事前調査の流れ
- 機能性の根拠の書類作成 03〜08(研究レビューまたは臨床試験)
- 届出書類作成の流れ
- 届出の流れ
- 機能性表示食品の届出時の注意点の例
- A.健康の維持と増進を目的としているため、予防や治療の臨床試験結果が使えない。
- B.臨床試験の被験者は健常人である。
- C.年齢層と性差による有効性の違いが無い事を考察する必要が有る。
- D.一般化されている評価方法で評価する必要が有る。
- E.人種や生活様式による違いが無い事を考察する必要が有る。
- F.機能性や対象者の限定がパッケージ・広告で適切に伝わるようにする。
- G.医薬的効能効果への接近・暗示は、受理後も撤回のリスクを伴うので避ける。
- H.作用機序も不十分であれば、受理後も撤回のリスクが伴うので適切に作成。
- I.採用したものがSR(研究レビュー)とRCT(最終製品の臨床試験)かの明示して消費者の誤認を避ける。
- J.表示文言に於いて効果の断定(言い切り)か補佐(助ける、サポート)かを明示して誤認を避ける。
- L.届出した機能性のみ表示出来る(他の機能性は表示出来ない)。
- M.原材料メーカー様から正当な許諾を得たうえで届出書類を使わせていただく方法も有る。
- 機能性表示の評価指標
- 届出実績とサポートの種類
機能性表示食品の特徴、費用、期間
機能性表示食品は消費者庁の制度の1つです
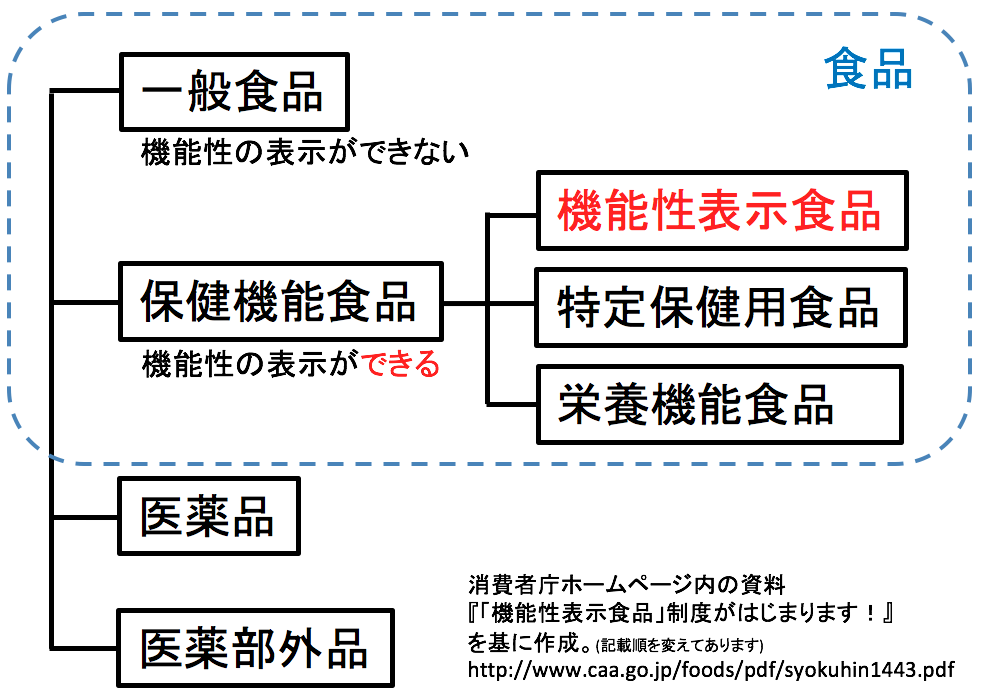
食品の機能性の表示可否に関しては、大きく分けて一般食品と保健機能食品が有ります。
一般食品(一般的な食品)は、機能性を表示出来ません。
保健機能食品は、機能性を表示出来ます。
この保健機能食品は①機能性表示食品、②特定保健用食品(特保、トクホ)、③栄養機能食品で構成されております。
保健機能食品の特徴
①機能性表示食品は従来制度である②特定保健用食品(トクホ、トクホ)よりも短期間・低コストという利点が有ります。
②特定保健用食品(特保、トクホ)は、メーカー様が自費で行わねばならない動物試験やヒト試験・臨床試験が多くいです。
そのため消費者庁での許可を得る審査のハードルが高いのがネックです。
③栄養機能食品は、国が定める約20種類の物質を必要量含有させておけば、申請・届け出など無しで商品パッケージに表示出来ます。
しかし、種類の少なさと表示出来る内容が限られているのがネックです。
[制度説明①] 機能性表示食品の費用・期間
【機能性表示食品】の費用・期間
費用:
研究レビューを新たに作成のうえ各種届出書類を作成して届出をする場合は200〜500万円前後です(研究レビューで採用する論文のデータ数により価格が大きく変動いたします)。
材料メーカー等から研究レビューや安全性データの提供が有る場合は、50〜100万円前後に費用を抑える事が可能です(その研究レビューをそのまま使用出来る場合)。
期間:
既存の臨床試験論文(自社他社問わず)を用いて研究レビューを作成する場合は、約6〜11ヶ月で発売となります。

【参考】
研究レビューの代わりに新たに臨床試験を行う方法もあります。
研究レビューが2〜4週間で作成できる事に対し、臨床試験は48〜72週間かかります。
現在、機能性表示食品として受理されている商品の9割以上が研究レビューを採用しており、新たに臨床試験を行う割合が少ないのが現状です。
メリット:
必要な書類の内容が少ない。届出から受理までの期間が短い(6〜11ヶ月)。
デメリット:
消費者庁は許可ではなく受理(書類の不備を確認)するという制度のため、発売後に第三者による指摘が発生して書類の修正が必要になる可能性が有る。
機能性表示食品は、2015年4月から始まった制度であり、 安全性情報と機能性情報を消費者庁に届け出て受理(審査や許可では無く受理です)される事により、先述の特定保健用食品(特保、トクホ)のように有効性を表示できます。
特徴としては、特定保健用食品(特保、トクホ)よりも短期間・低コストという利点が有ります。
必要な書類は大きく分けて「安全性の根拠」「生産・製造及び品質の管理」「健康被害の情報収集体制」「機能性の根拠」「表示の内容」の5つ有ります。
1.安全性の根拠:日本での食経験または安全性試験など。
2.生産・製造および品質の管理:製造施設情報および栄養成分・機能性関与成分の分析方法と分析結果。
3.健康被害の情報収集体制:消費者からメーカーへの問い合わせ手段、メーカー社内の組織図、消費者からメーカーへ問い合わせに対する対応・協議のフローチャート。
4.機能性の根拠:『健常人に於ける臨床試験結果を論文投稿したもの』または『臨床件結果の論文を収集して評価した研究レビュー』。
5.表示の内容:商品パッケージのデザイン。
「4.機能性の根拠」については、以下2点から選択可能です。
■A.最終製品を用いた臨床試験結果を査読付きの論文にしたもの』
■B.最終製品又は機能性関与成分に関する研究レビュー(SR、システマティックレビュー)
■A.最終製品を用いた臨床試験結果を査読付きの論文にしたもの
商品そのもの(最終製品)を被験者さんに摂取していただき、どのような機能性があるかの確認を行います。
これを臨床試験とかヒト試験と呼びます。臨床試験の方法についてはこちらのページ(臨床試験の実施)をご覧ください。
論文投稿というのは査読(さどく)の有無で2つに分かれます。
機能性表示食品の「A.」の場合で届出に使えるのは査読員(さどくいん)という審判・レフリーによる審査が有る論文だけです。
この査読により正しい研究かどうかが確認されております。
論文投稿の方法についてはこちらのページ(論文投稿や学会発表の流れについての説明)をご覧ください。
■B.最終製品又は機能性関与成分に関する研究レビュー(SR、システマティックレビュー)
機能性の関与成分を含んだヒトでの論文(自社他社問わず)を世界中から収集してスコア化・考察を作成した書類です。
考察では「収集した論文で1日10グラム飲むと機能性が有ると証明していた為、我が社は10グラムを含有している商品を作る事とした」のように機能性を期待できる根拠を説明します。
これを研究レビューとかシステマティックレビュー(systematic review、略してSR(エスアール))と呼びます。
この研究レビュー(システマシックレビュー、SR)についてはこちらのページ(研究レビューの作成サポート)をご覧ください。
[制度説明②] 特定保健用食品(特保)の費用・期間
【特定保健用食品(特保)】の費用・期間
費用:
以下の研究を全てを行う必要が有る性質上、場合によっては1〜2億円のような高い費用がかかります。
必要な研究は、作用機序の研究、安全性試験(動物、ヒト)、遺伝毒性(菌株等)、用量設定試験(ヒト)、機能性評価試験(ヒト)など多岐に渡る。
期間:
必要な研究を行うため2〜5年、更に消費者庁への申請後から許可まで1〜5年の合計3〜10年もの期間がかかる。
メリット:
①機能性表示食品について消費者庁は「書類に不備は無いが内容の真偽は不明。
審査や許可ではなく受理である。
責任は全てメーカーに有る」という立ち位置であるが、②特定保健用食品・トクホについて消費者庁は書類の真偽も審査しているため、一般的に①機能性表示食品よりも科学的な水準が高く第三者による指摘が非常に少ない。
商品パッケージに表記するマークの認知度が高い(30年前から有る制度のため)。
デメリット:
①機能性表示食品と②特定保健用食品・トクホの明確な違いを購入者が理解していない事も有り、その場合は費用対効果が低い。
必要な研究を行うため2〜5年、更に消費者庁への申請後から許可まで1〜5年の合計3〜10年もの期間がかかるため、すぐに発売出来ない。
②特定保健用食品(特保)よりも①機能性表示食品の方が表示出来る内容の自由度が高くなるという逆転現象が稀に発生している。
特定保健用食品は、約30年前(1991年〜)から施行されている制度です。
関与成分が添加された個々の商品について作用機序の解析、動物試験、ヒト試験・臨床試験などを実施し、消費者庁の審査・許可を受けた商品です。
血圧・血糖値・体脂肪・中性脂肪・整腸などについて 「糖の吸収を穏やかにするので、食後の血糖値が気になる方に適しています。」 「おなかの調子を整えたい方やお通じの気になる方に適しています。」 などのように機能性を表示できます。
[制度説明③] 栄養機能食品の費用・期間
【栄養機能食品】の費用・期間
費用:
栄養機能食品は消費者庁などへの届出や申請は不要で、自社のみで取り組まれる場合は栄養成分の分析のみの外注の場合が多く、栄養成分の分析会社さんにお支払いいただく分析費用は2〜3万円のみで済む事があります。
この栄養機能食品についても、(株)機能食品研究所にてご支援・コンサルティングさせていただきます。お気軽にご相談ください(お問い合わせはこちら)。
おそらく1度このご支援・コンサルティングを受けていただくと、今後は御社様のみで栄養機能食品の取り組みが出来ると思います。
期間:
栄養成分の分析の依頼にかかる2〜3週間のみ。
メリット:
申請や届出は不要。
デメリット:
該当する物質数が少ない(20種類)。
定められた機能性の表現の種類が少ない。
定められた機能性の表現を改変する事無く記載せねばならない。
栄養機能食品は、含有される栄養成分に限定される制度です。
国が定めた規格基準の一覧表内にある成分に関して、一日当たりの摂取目安量に含まれる当該栄養成分量が定められた上・下限値の範囲内にあれば以下のように機能性を表示できます。

該当する物質・1日あたりの摂取目安量と定められた機能性の文言
■脂肪酸
・N-3系脂肪酸(0.6〜2.0g/day):皮膚の健康維持を助ける。
■ミネラル類
・亜鉛(2.64〜15.00mg/day):味覚を正常に保つ。皮膚や粘膜の健康維持。たんぱく質・核酸の代謝に関与して健康の維持に役立つ。
・カリウム(840〜2,899mg/day):正常な血圧を保つ。
・カルシウム(204〜600mg/day):骨や歯の形成に必要。
・鉄(2.04〜10mg/day):赤血球を作るのに必要。
・銅(0.27〜6.0mg/day):赤血球の形成を助ける。多くの体内酵素の正常な働きとエネルギー産生を助けるとともに、血液循環を正常に保つのに必要。
・マグネシウム(96〜300mg/day):骨や歯の形成に必要。多くの体内酵素の正常な働きとエネルギー産生を助けるとともに、血液循環を正常に保つのに必要。
■ビタミン類
・ナイアシン(3.9〜60.0mg/day):皮膚や粘膜の健康維持を助ける。
・パントテン酸(1.44〜30.00mg/day):皮膚や粘膜の健康維持を助ける。
・ビオチン(15〜500μg/day):皮膚や粘膜の健康維持を助ける。
・ビタミンA(231〜600μg/day):夜間の視力の維持を助ける。皮膚や粘膜の健康維持を助ける。
・ビタミンB1(0.36〜25.00mg/day):炭水化物からのエネルギー産生と皮膚や粘膜の健康維持を助ける。
・ビタミンB2(0.42〜12.00mg/day):皮膚や粘膜の健康維持を助ける。
・ビタミンB6(0.39〜10.00mg/day):たんぱく質からのエネルギー産生と皮膚や粘膜の健康維持を助ける。
・ビタミンB12(0.72〜60.00μg/day):赤血球の形成を助ける。
・ビタミンC(30〜1000mg/day):皮膚や粘膜の健康維持を助けるとともに、抗酸化作用を持つ。
・ビタミンD(1.65〜5.00μg/day):腸管でのカルシウム吸収を促進し、骨の形成を助ける。
・ビタミンE(1.89〜150mg/day):抗酸化作用により、体内の脂質を酸化から守り、細胞の 健康維持を助ける。
・ビタミンK(45〜150μg/day):正常な血液凝固能を維持する。
・葉酸(72〜200μg/day):赤血球の形成を助ける。胎児の正常な発育に寄与する。
機能性表示食品と【特定保健用食品・特保】【特定用途食品】【栄養機能食品】の重複表記は出来ません事をご留意ください。
消費者庁のホームページのトップから 食品表示 > 食品表示一元化情報 の順にページを進んでいただいた所にある『食品表示基準について(平成27年3月30日消食表第139号)』の『別添 機能性表示食品関係』のと言うPDFの頁番号1に以下の通り記載されております。
以下の食品については、機能性表示食品の対象から除くこととする。
①特別用途食品及び栄養機能食品
消費者が製品を選択する際、複数の機能性表示制度に基づく表示が記載されていると、それぞれの記載がいずれの制度に基づく表示であるのか混乱を招くおそれがある。当該混乱を防止するため、また、各制度の趣旨の違いに鑑み、従来の機能性表示制度に基づく食品(特定保健用食品と栄養機能食品)及び特定保健用食品を除く特別用途食品との併用は認められない。
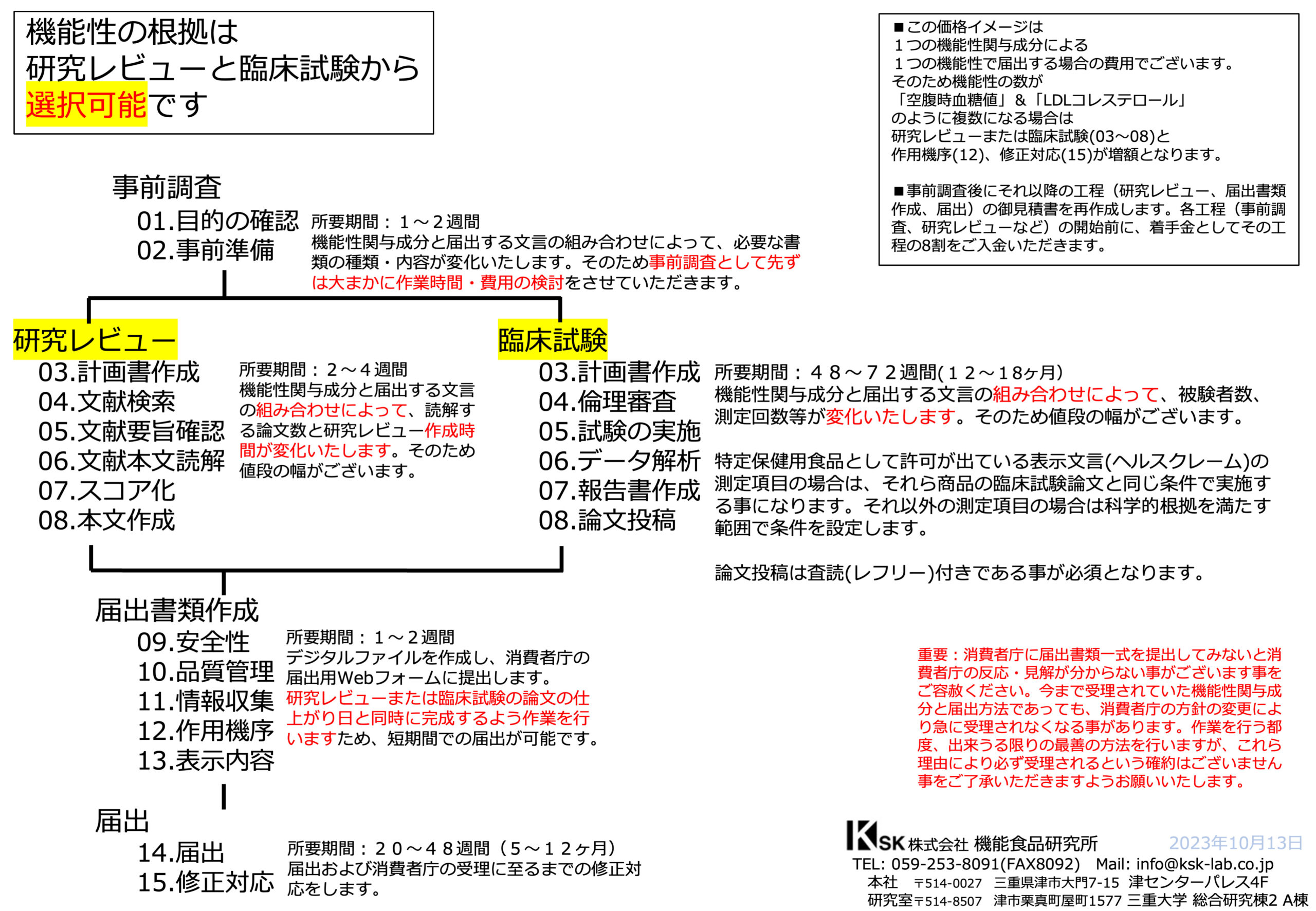
機能性表示食品の届出(申請)に必要な書類と作業工程
届出に必要な書類は5種類あります
機能性表示食品の届出(申請)には、大きく分けて以下1〜5の書類が必要です。
これらのうち、4.機能性の根拠(研究レビューまたは臨床試験)については、以下①〜②から選択出来ます(両方同時に用いる事も可能)。
→①最終製品または機能性関与成分に関する研究レビュー(SR、システマティックレビュー)
→②最終製品を用いた臨床試験(ヒト試験、食品試験)の結果を査読(掲載審査)付きの論文に投稿したもの
届出の作業工程を15工程に分けて進めます
機能食品研究所では、届出(申請)にかかるサービスの工程を以下01〜15の工程順に分けて進めております。
本ページでは以下の図の赤枠で囲いました届出全般(事前調査(01〜02)、届出書類作成(09〜13)、届出(14〜15))についてご説明いたします。

事前調査の流れ

所要期間:1〜2週間
機能性関与成分と届出(申請)する文言の組み合わせによって、必要な書類の種類・内容が変わって参ります。
特に安全性の資料と機能性の臨床試験論文(研究レビュー作成用)の数が大きく変動します。
なお、機能性の臨床試験の論文が無い場合、臨床試験を実施する必要があります。
そのため事前調査として先ずは目的を確認し、事前準備として作業時間の検討をいたします。
既存の表示文言(ヘルスクレーム)の場合:
どのような評価項目でどのような測定値の変動があれば受理されるであろうという目安がございます。
そのため研究レビュー作成前に行う事前調査の時点でネックとなる部分の大体の予想が付きます。
新しい表示文言(ヘルスクレーム)の場合:
消費者庁からどのような理由で差し戻しが有るか推測が困難な場合がございます。
この場合、届出をして1度目の差し戻しが来てようやくその見当が付く事があります事をご容赦願います。
01.目的の確認
目的をヒアリング
先ずはお客様の目的を確認するため、mail・電話・Web会議等にてヒアリングを行います。
伺います内容は以下のようなものです。
- どのような機能性関与成分であるか?
- どのような機能性の表示文言(ヘルスクレーム)を表示されたいか?
- いつまでに発売されたいか?
- 機能性関与成分の機能性・安全性についてお手持ちの資料があれば種類と内容
必要に応じてWeb会議を用いて制度をご説明
機能性表示食品の開発・発売のため、御社様内で多くの方々が関わられると思います。
→安全性の根拠:開発・研究のかた
→生産・製造及び品質の管理:工場・生産のかた
→健康被害の情報収集体制:お客様相談室のかた
→機能性の根拠:開発・研究のかた
→表示の内容:営業・広報、デザイン・企画のかた
このように多くの方方々が関わられる場合、以下のようなお困りが生じる事が有ります。
・社内の各々の担当者さんに「こうやって書いてください」という説明をしてまわる時間が割かれる
・1日中、あちこちの担当者さんから書き方についての質問が寄せられて、その都度自分の仕事が中断される
・部署毎に縦割りの関係のため、他部署への依頼・説明で気を遣わねばならない
そのお困りを解決するため、
必要がございましたらビデオ会議(Zoom、Teams等)を用いて
機能性表示食品の制度のご説明をさせていただきます。
以下のような内容で30分程度でご説明をさせていただきます。
皆様お忙しいと存じておりますため、30分で簡潔に要点をお伝えさせていただきます。
①既存の制度との違いについて(機能性表示食品、特保、栄養機能食品)
②どのような機能性を表示出来るかの例
③対象商品となるかの判断方法について
④安全性の根拠の書類で必要な情報について
⑤生産・製造及び品質の管理の書類で必要な情報について
⑥健康被害の情報収集体制の書類で必要な情報について
⑦機能性の根拠の書類で必要な情報について
⑧商品パッケージに表記する必要のある情報について
ビデオ会議にご出席いただいた方々からご感想をいただきました。
・噛み砕いた説明だったから分かりやすかった。おかげで短時間で全体像を把握できた。
・取引先に『いま機能性表示食品を目指しています』とお話できるよ。お話するからには内容を知っていなければ取引先から突っ込んだ質問を受けたらどうしようと思っていたけど、これで自信をもって話せるよ
・社内に良いアイディアをたくさん提案できそう。今までは制度の全体像が分かっていなかったから、提案して進めて良いのだろうかとか後になって思わぬ壁にぶつかったらどうしようかと、後ろ向きだったです。
02.事前準備
情報の確認、探索、検討
目的の確認の次は、弊社にて以下のような事前準備を行います。
機能性関与成分の機能性・安全性についてお手持ちの資料があれば種類と内容をお教えいただき、それにより以下2つのパターンから選択して実施します。
■パターン1:
お客様から機能性・安全性に関する資料をご提供いただいた場合(部分的な情報も可)。
1.お客様からいただきました機能性に関する論文の要旨・図表を簡易的に読解。これにより有効性関与成分に関する下調べが速くなります。
↓
2.安全性書類をお客様からいただくまたは弊社で予備探索。副作用、医薬品との阻害・亢進作用など知っておきますと論文検索の工程にて参考になります。
↓
3.機能性に関する論文数の予備検索。お客様がお持ちの論文の他に、大体どれくらい論文が存在するかを把握します。
邦文・英文の論文の題名・要旨を検索し、研究レビュー作成のためにどのような量の作業が必要になりそうかを簡易的に判断します。
↓
4.機能性に関する論文の要旨・図表を簡易的に読解。「1.」でご提供いただきました論文内容のみで充足出来る場合はスキップする事があります。
■パターン2:
弊社で全て機能性・安全性に関する資料を探索する場合。
1.安全性書類を予備探索。副作用、医薬品との阻害・亢進作用など知っておきますと論文検索の工程にて参考になります。
↓
2.機能性に関する論文数の予備検索し、大体どれくらい論文が存在するかを把握します。
邦文・英文の論文の題名・要旨を検索し、研究レビュー作成のためにどのような量の作業が必要になりそうかを簡易的に判断します。
↓
3.その他の機能性に関する論文の要旨・図表を簡易的に読解。
そして、これら結果を基に、以下A〜Cを書き出していきます。
A.この(商品の)機能性関与成分で届出をされるには、どんな作業を行う必要が有りそうか?
B.各作業行程で何時間ずつかかりそうか?
C.ネックになると予想される問題が有りそうか?否か?
■A.この(商品の)機能性関与成分で届出をされるには、どんな作業を行う必要が有りそうか?
以下1〜5の内容について、どのような書類をどのような資料を用いて作成していくかというイメージを書き出します。
1.安全性の根拠
2.生産・製造及び品質の管理
3.健康被害の情報収集体制
4.機能性の根拠(研究レビューまたは臨床試験)
5.表示の内容の情報
■B.各作業行程で何時間ずつかかりそうか?
そして上述の「A.」で書き出した項目の作成にかかる予想時間を推測します。
特に作成にかかる時間で大きく変動するのが【『1.安全性の根拠』で用いる資料の数】と【『4.機能性の根拠(研究レビューまたは臨床試験)』の研究レビューで用いる根拠論文数または実施が必要な臨床試験の規模】です。
なお、『4.機能性の根拠(研究レビューまたは臨床試験)』について補足を申し上げます。研究レビュー作成のための根拠論文が存在しない場合、最終製品にて臨床試験(ヒト試験、食品試験)を実施して論文投稿まで行う必要があります。この臨床試験・ヒト試験の実施は研究レビュー作成よりも時間がかかるというネックが有ります。
その理由ですが、研究レビュー作成は既存の臨床試験論文の読解が中心のため4〜8週間で完成するところ、臨床試験の実施と結果の論文投稿は摂取期間や論文投稿期間などとの兼ね合いにより48〜72週間(12〜18ヶ月)かかり、その大きな時間の差は届出受理・商品発売の時期に影響して参ります。
■C.ネックになると予想される問題が有りそうか?否か?
この事前調査の時点で『ネックとなると予想される問題』が判明しましたら、その時点で分かりうる解決策またはリスクをご報告します。
事前調査後(研究レビューや届出書類の作成時または届出後)に新たに判明する問題もございます事をご容赦願います。
事前調査報告書の提出
これら「01目的の確認」「02事前準備」の内容をまとめ、事前調査報告書を作成します。作成はパワーポイントで行い、メールでの納品となります。
この事前調査報告書には、『研究レビュー作成や届出書類全般作成にかかると予想される時間とその根拠』も記載いたします。
(実際の作業時間が予想と前後する事もございます事をご容赦願います)
今後の作業において想定される作業時間も記載しますので、御社様社内で行われるか外注されるかのご判断材料にもお使いいただけます。
想定される作業時間のご説明例
① 目的立て
作業時間として●時間=2名×●時間かかると予想されます。
発売されている機能性表示食品の届出番号「●●●番」「●●●番」を参考に、機能性表示の文言について■■という機能性に焦点を当てるべきか、▼▼▼という機能性に焦点を当てるべきか、両方に焦点を当てるべきかを検討し、それに沿って目的を立てていただくのも方法の1つです。
② 文献検索
●時間=2名×●時間
検索をかけた後、検索日・検索結果の数値・文献を除外していく工程のフロー図・除外した文献の名称等情報などを研究レビューに記載していただきます。
検索エンジンのうちPubMed(パブメド)やUMIN(ユーミン)は無料使用出来ますが、有料のものはIDやPASSの発行に2週前後要するものも有るため前もって発行手続きをされる事をお勧めします。
③ 論文内容の数値化・評価
●時間=2名×●時間
その論文の研究に恣意・科学的なミスが入っていないか等について、スコア付けをしていただきます。
スコア付けを各研究員各々で行った後、照らし合わせる事を留意してください(他の工程も各々の研究員で行うべき内容が有ります事にご注意願います)。
④ 研究レビューの作文・作表
●●時間=2名×●時間
①②③の内容を文章・表の作成をしていただきます。
この文章に記載した内容を基に、商品のパッケージに記載する文言を作文する事になるため、パッケージに入れ込みたい内容を研究レビューに記載する必要が有ります。研究レビューは読み込んだ論文を元に作成する事から、論文から読み解けない内容を恣意的に記載される事は避ける必要が有ります。
⑤届出全般の資料(安全性、分析(定性・定量)、製造等)の作成
●●時間=1名×●時間
安全性資料の作成ですが、●●というデータベースに△△という記述がありますため、それを引用する事になりそうです。
定性(機能性関与成分が含まれている証明)は●●法、定量は●●法と予想されます。製造の資料については、●●に●●●のようにお伝えください。
パッケージ見本ですが、●●●のような強調表現をすると●●と指摘される可能位がありますためご注意ください。事前調査のみも承っております
事前調査のみのご依頼も可能です。
事前調査結果は、御社様独自で行われる届出作業に於いて以下の通りお役に立ちます。
1.所要時間の見通しが立てやすくなる。
2.どのような部分にお気をつけいただくべきか明確になる。
機能性の根拠の書類作成 03〜08(研究レビューまたは臨床試験)
機能性の根拠は研究レビューまたは臨床試験から選択して作成します。
これら03〜08の工程は、以下のページをご覧ください。
(説明内容が多いため各々別のページに記載してございます)

届出書類作成の流れ

所要期間:1〜2週間
この工程では、消費者庁への届出書類の作成をします。
研究レビュー完成と届出書類完成が同時期になるよう作業開始時期を調整し、期間短縮を致します。
09.安全性
届出に必要な情報の1つとして安全性の根拠の情報がございます。
この安全性に問題があれば届出が出来ない事が有るため、とても重要です。
問題が有る場合でも、場合によってはパッケージへの表示内容に安全に摂取する方法について注意喚起すれば発売出来る事も有ります。例えば、お薬との飲み合わせへの注意喚起が有ります。
この事から安全性の問題を発見した時点で対策を考えるという進め方をします。
安全性の根拠については、以下1〜3の項目順に情報を探索します。
なお、安全性の根拠が充分と判断できた項目以降の探索は任意となります。
1.その商品や類似物質での食経験(食されてきた年数、消費量、出荷量)
↓
2.ヒトでの安全性試験
↓
3.動物などでの安全性試験
これら情報の探し方ですが、研究機関等によっては多数の品目・成分の文献の安全性・有効性の要点をまとめたデータベースを一般公開しており、引用も可能です。
弊社の場合、メーカー様からご相談を受けた際、先ずメーカー様が把握されている情報を伺い、それら資料のみで充足出来るかを判断しております。
それらでは不足している場合は、世の中に存在しているデータを検索・探索いたします。
該当するものが無い場合、動物試験や臨床試験等による安全性データの取得をご提案いたします。
安全性の根拠については日本等での食経験が長いものは、その情報のみで安全性の根拠に出来る事が多いです。
自社の商品(類似商品も場合によっては可)の自社データや、他社商品や材料などについての公知のデータ(論文、業界紙、データベース等)を引用して作成します。
例:日本で50年前から毎年数百トン消費されている。類似商品を10年前から販売していて、累計100万食販売されている。
食経験が短いものなどについては、動物試験などによる安全性試験結果を自社データまたは公知のデータ(論文、業界紙、データベース等)を引用して作成します。
例:マウスで3ヶ月の投与で血液・内臓に異常無し。変異原性(菌の培地に曝露させる)に於いても(菌の繁殖力に)異常無し。
動物試験・細胞試験などの種類は以下の通りです。
・単回投与毒性試験(別名:急性毒性試験、急毒(きゅうどく))
マウスやラットに1度だけ食べて貰い、安全性を確認します。
人間の体重に換算して、これ以上食べないだろうという量を食べて貰うのですが、口からチューブを入れて注射器で押し出します。
これにより多量に1度に食べた時の短期的な安全性が分かるのです。
・反復投与毒性試験(別名:慢性毒性試験、慢毒(まんどく))
マウスやラットに1~9ヶ月間毎日食べて貰い安全性を観察します。
自由摂餌(じゆうせつじ)と言って、ご飯に混ぜておいて食前食後に重さを量って毎日食べた量を記録しておく方法と、先述の口からチューブを入れて注射器で押し出す方法が有ります。
・有効性確認試験(別名:機能性確認試験)
高血圧、高脂血症、糖尿病など特定の症状になりやすいマウスやラットをブリーダー(繁殖所)から購入してきて試験をします。
これら動物をモデル動物と言いまして、世界中どこでも同じ遺伝子・特徴の固体を購入出来ます。これらマウスやラットに機能性の関与成分も食べて貰い、症状の緩和程度を確認観察します。
・遺伝毒性試験
ニワトリの赤血球を取り出して来て機能性の関与成分を振りかけてみて遺伝子に悪影響が無い事を見たり、菌の培地に振りかけても繁殖力に異常が生じない(遺伝子に悪影響が無い)事を確認します。
成分によっては菌との相性が悪かったりするため、擬陽性(ぎようせい)といって事実では無い結果が出る事もあるので、1つの結果を鵜呑みにせず複数の研究方法で確認する事も有ります。
過剰摂取による安全性情報の考え方について
機能性表示食品の食品形態は以下3つ有ります。
①「サプリメント形状の加工食品」
②「その他の加工食品」
③「生鮮食料品」
①は商品に含有する機能性関与成分に
換算して5倍量の摂取用量で安全という情報、
②③は3倍量の情報を意識して探索します。
①「サプリメント形状の加工食品」
②「その他の加工食品」
の違いは、多量に摂取できる可能性のあるものは
①扱いとなり5倍量の情報が必要でございます。
10.品質管理
生産・製造及び品質の管理について、資料を作成します。
生産については、商品の企画書・規格書を作成します。この情報は非公開扱いのため消費者庁のWebページでの公開には含まれておりません。
製造については、生産工場の所在地およびISOやGMPへの準拠の有無の書類を作成します。この情報は公開扱いです。
品質の管理については以下の情報を記載します。
→①機能性関与成分などの定性や定量をする機関名(場合によっては頻度)
→②実際に定性や定量した結果の書類(成績書)を作成
→③定性や定性方法の手順書も作成します
②は非公開ですが、①と③は公開扱いです。
しかし③のうち外秘扱いにしたい部分については、公開用(一部黒塗り)と非公開用のPDFを各々提出し、公開用のみ消費者庁のWebページで公開という方法も可能です。
加工食品やサプリメントの場合、どのように安全な設備の生産工場で製造され、機能性の成分がパッケージ表示通り含まれて居ることをどのように測定するかを記載します。
例:ISO(製造などに関する基準)を満たした工場で製造し、機能性の成分が正しく含まれて居る事を材料の入荷毎に確認している。
生鮮食料品の場合は、どのような農場・漁場でどのような方法で栽培・収穫・水揚げし、どのような方法で機能性の成分がパッケージ通り含まれており、どのような場所で包装・出荷をしているという情報を記載します。
例:○○県○○市の管理された農場で栽培、機能性の成分が正しく含まれて居る事を週に1度確認、○○県○○市の工場にて包装して出荷。
11.情報収集
健康被害の情報収集体制について、『お客様相談室・窓口の連絡先(電話番号等)』『組織図』『お客様窓口からの有害事象対策フローチャート』を作成します。
これらのうち『お客様相談室・窓口の連絡先(電話番号等)』については、消費者庁Webページ上での公開されます。
一方、『組織図』と『お客様窓口からの有害事象対策フローチャート』については消費者庁のホームページで公開される資料には含まれておらず非公開扱いです。
商品パッケージに載るお客様相談室の連絡先や営業時間などの情報の他、お客様相談室の電話番号にかかってきた内容を社内でどのように伝達・協議・対応するかの情報も届出しています(一部、非公開情報扱いです)。
12.作用機序
機能性関与成分がヒトの体内でどのような理由・メカニズムで機能しているかという作用機序の説明文章を作成します。
これら情報は研究レビューで採用する臨床試験論文から引用する事が多いですが、動物試験の論文等を探索して引用する事もございます。
この文章が研究レビューで導き出された機能性の裏付けになりますので、どの表示文言と作用機序が合致しているかに注意をして作文する必要が有ります。
13.表示内容
先ず、弊社にてパッケージに入れ込んでいただく文言・文章を作成したデジタルファイルをお渡しします。
それを御社様のデザイン担当の方にパッケージデザインに入れ込んでいただき、完成した稿をPDFにして届出に用います。
商品パッケージのデザインも届出書類として消費者庁に提出されています。
後からデザインやキャッチフレーズを変えてしまうと、消費者庁が受理していないつまり意図から外れた内容になってしまう可能性が有るからです。
届出が受理されてからのパッケージの変更は、消費者庁への変更申請(軽微な修正は2〜5週間で受理)が必要となります。
届出の流れ

所要期間:20〜48週間(5〜12ヶ月)
この工程では届出および消費者庁の受理に至るまでの修正対応をします。
14.届出
先ずは、御社様の届出(申請)用IDとPASSの発行を行います。
IDとPASSの発行は、Webのみの手続きで即日発行が可能です。
それらの情報を用いて消費者庁のデータベースにアクセスし、届出の書類をアップロードします。
届出の翌営業日の朝6時に、以下のようなメールが消費者庁から届きます。
件名: 【機能性表示食品制度】届出情報の仮受付について
本文:機能性表示食品制度の届出情報を仮受付いたしました。
※受付はまだ完了していません。
弊社では、このWebでのIDとPASSの発行方法から届出の書類のアップロード方法まで詳細な手順書をお渡しさせていただいております。
文章を1つ1つWebフォームにコピー&ペーストする部分と、PDFファイルにしてアップロードする部分がありますので、どのファイルを事前にPDFにしておくと効率的であるかも、弊社がお渡しする手順書に記載してございます。
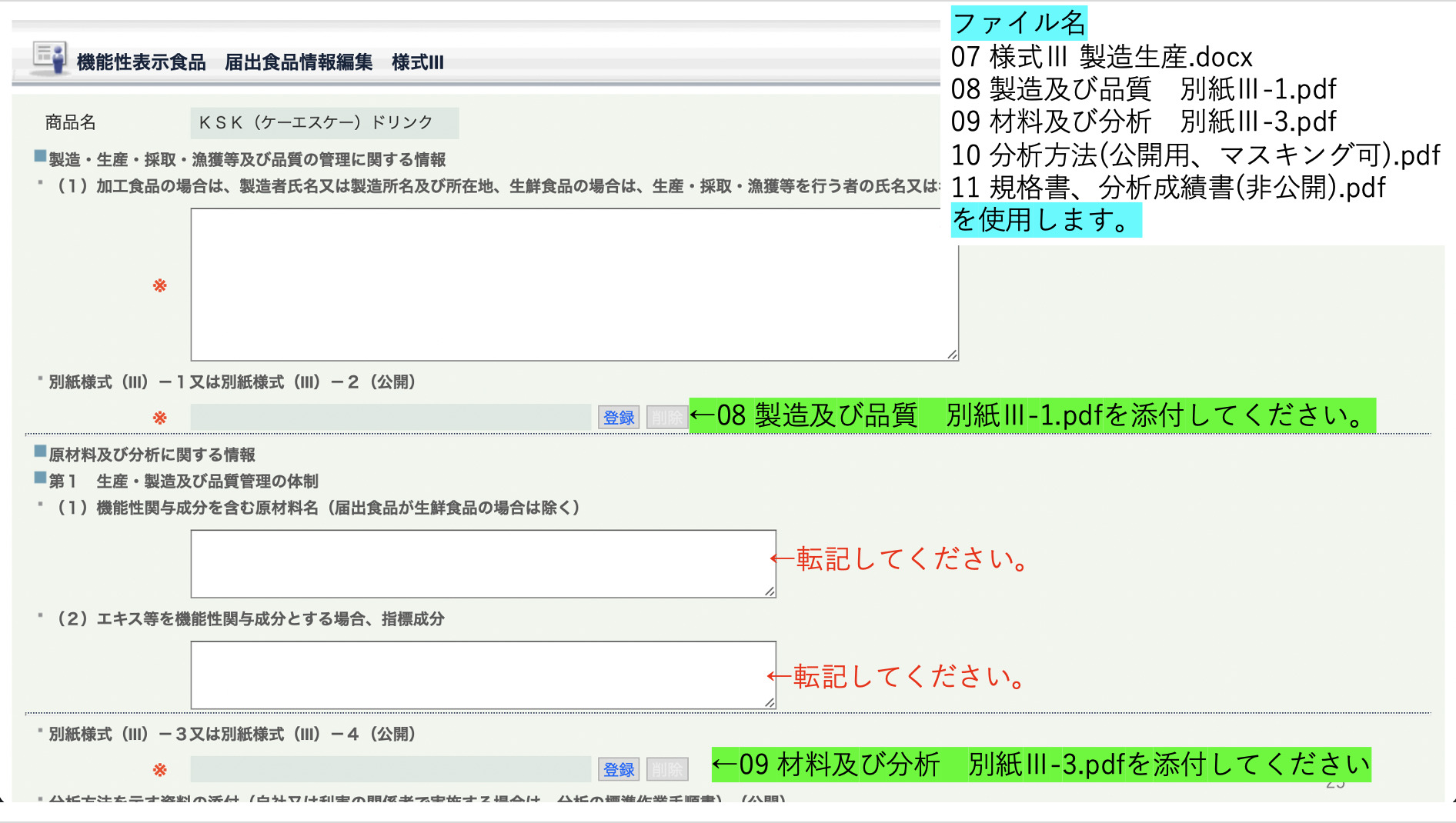
画像:手順書のイメージ
弊社では、以下のようなファイルを用いてお客様と作業を円滑に進めて参ります。
例:加工食品(エキス不使用)の場合の場合のファイル
以下のファイルに内容を作成していき、届出時には消費者庁のWebフォームにコピー&ペーストしていきます。
ファイル名末尾に「(.pdf)」と書いてあるものは、PDF化してアップロードします。
■基本情報
01 届出食品基本情報 様式1.docx
02 チェックリスト 様式2.xlsx(.pdf)
03 消費庁への連絡コメント(2回目提出以降).docx(.pdf)
■様式Ⅰ
04 様式Ⅰ 届出食品情報.docx
■様式Ⅱ
05 様式Ⅱ 食経験と安全性.docx
06 安全性評価シート 別紙Ⅱ-1.docx(.pdf)
■様式Ⅲ
07 様式Ⅲ 製造生産.docx
08 製造及び品質 別紙Ⅲ-1.docx(.pdf)
09 材料及び分析 別紙Ⅲ-3.docx(.pdf)
10 分析方法(公開用、マスキング可).pptx(.pdf)
11 製品規格書、分析成績書(非公開).pptx(.pdf)
■様式Ⅳ
12 様式Ⅳ 健康被害の情報収集体制.docs
13 組織図及び連絡フロー(非公開).pptx(.pdf)
■様式Ⅴ
14 様式V 機能性.docx
15 研究レビュー 別紙V-1-16.pdf
16 機能性点検表 別紙Ⅴ-1.docx
17 SR説明資料 別紙Ⅴ-4.docx
18 SR表 別紙Ⅴ-5-16.xlsx
■様式Ⅵ
19 様式Ⅵ 表示内容と見本.docx
20 パッケージ見本.pptx(.pdf)
■様式Ⅶ
21 様式Ⅶ 作用機序.docx
22 作用機序に関する説明 別紙Ⅶ-1.docx(.pdf)
■その他(弊社とお客様の打合せ用)
23 消費者庁ユーザーID発行方法について.pptx
24 消費者庁へのWebでのアップロード手順.pdf
25 ファイル一覧、届出に向けた準備について(Web会議用スライド).pptx
15.修正対応
届出から約50日で消費者庁より受理または差し戻し(修正の必要事項)について消費者庁からメールで連絡が届きます。
→受理された場合
件名:【機能性表示食品制度】届出の受付完了について
本文:機能性表示食品制度における届出の受付が完了いたしました
受付番号:
商品名:
届出日:
届出番号:
→差し戻しされた場合
件名:【機能性表示食品制度】届出の不備について
本文:機能性表示食品制度における届出の内容に不備がありました
お持ちのIDにて「機能性表示食品制度届出データベース」に
ログインし、差戻し理由、コメントの内容を御確認いただき、
届出内容の修正を行ってください。
差し戻しされた場合、その内容に沿って修正を行い、再提出をします。
消費者庁から御社様宛に差戻しが来ると予想される時期の少し前に、弊社から御社に「そろそろ消費者庁から連絡メールが来る頃です」というリマインドメールを送らせていただきます。
発売予定日の設定について
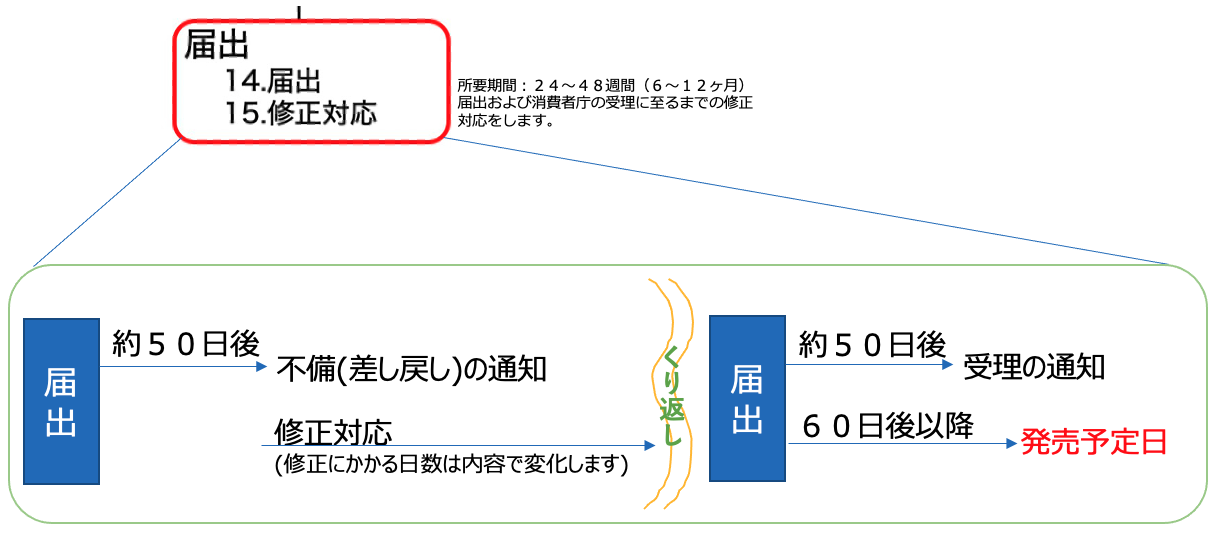
Webでの届出を行う毎に、その届出日から60日を切らない発売予定日を設定します。
届出をすると約50日後に受理または不備(差し戻し)の通知が届きます。
発売予定日の設定によっては、受理の通知から発売日まで最短で10日前後となります。
届出の資料に表示見本(パッケージのデザイン)も含まれますため、その内容に不備(差し戻し)が生じる事もあるため通知前の製造開始はリスクが有ります。
受理の通知時に付与される届出番号(パッケージへの表記が必須)については、パッケージの上からシールを貼る方法もございます。
届出から約50日後に消費者庁から受理・差し戻しのメールが来ます
受理されました場合、消費者庁から届くメールの件名は以下の通りとなり、メール本文に商品に記載する届出番号が記載されます。
→受理された場合
件名:【機能性表示食品制度】届出の受付完了について
本文:機能性表示食品制度における届出の受付が完了いたしました
受付番号:
商品名:
届出日:
届出番号:
→差し戻しされた場合
件名:【機能性表示食品制度】届出の不備について
本文:機能性表示食品制度における届出の内容に不備がありました
お持ちのIDにて「機能性表示食品制度届出データベース」に
ログインし、差戻し理由、コメントの内容を御確認いただき、
届出内容の修正を行ってください。
そのメールは朝6時頃に届き、その日の夕方までに消費者庁の検索ページに反映されます。
その後に行う事は、実際の発売日を決定していただき、消費者庁の届出用のWebページに反映して完了です。
届出が受理されてからの流れ
1.発売開始
↓
2.発売を開始された時点で消費者庁のWeb届出画面の
販売ステータスに「発売中」のチェックを入れる。
↓
3.将来、もし機能性関与成分に関する新たな臨床研究論文が発表
それが研究レビューの追記修正が必要になるような内容と判断され
機能性表示食品の届出時の注意点の例
A.健康の維持と増進を目的としているため、予防や治療の臨床試験結果が使えない。
B.臨床試験の被験者は健常人である。
C.年齢層と性差による有効性の違いが無い事を考察する必要が有る。
D.一般化されている評価方法で評価する必要が有る。
E.人種や生活様式による違いが無い事を考察する必要が有る。
F.機能性や対象者の限定がパッケージ・広告で適切に伝わるようにする。
G.医薬的効能効果への接近・暗示は、受理後も撤回のリスクを伴うので避ける。
H.作用機序も不十分であれば、受理後も撤回のリスクが伴うので適切に作成。
I.採用したものがSR(研究レビュー)とRCT(最終製品の臨床試験)かの明示をして消費者の誤認を避ける。
J.表示文言に於いて効果の断定(言い切り)か補佐(助ける、サポート)かを明示して誤認を避ける。
L.届出した機能性のみ表示出来る(他の機能性は表示出来ない)。
M.原材料メーカー様から正当な許諾を得たうえで届出書類を使わせていただく方法も有る。
A.健康の維持と増進を目的としているため、予防や治療の臨床試験結果が使えない。
維持と予防はほぼ同じ意味という意見もありますが、機能性表示食品では「維持」である事を明記する必要が有あります。
予防や治療という言葉は使えません。その理由として、医薬品のような効果や効能があるものについて、日本の規則では食品として販売出来ない事が挙げられます。
B.臨床試験の被験者は健常人である。
食品は医薬品のような強い作用が無いため、臨床試験にて以下の問題が生じます。
→正常値の被験者では恒常性により低下作用が確認出来ない事。
→確認出来たとしても膨大な被験者数が必要となり費用対効果が低い事。
これらの解決策として、特定保健用食品(トクホ)では血圧、食後血糖値、食後中性脂肪などが境界域(正常値と異常値の境目)の他に軽症者を被験者に出来ます。
そして、特定保健用食品(トクホ)で境界域や軽症者を採用できている評価項目では、機能性表示食品でも採用可能です。
さらに最近の動向としては逆転現象が発生しており、特定保健用食品(トクホ)に存在していない測定項目についても、評価指標によっては機能性表示食品で軽症者を入れる事が出来るようになりました。
例:認知機能、目鼻のアレルギー、尿酸値
C.年齢層と性差による有効性の違いが無い事を考察する必要が有る。
考察が困難な場合、臨床試験結果の年齢層や性別のみを対象とした商品と記載する必要が有る。
年齢層による有効性の違いの例:
『イチョウ葉由来フラボノイド配糖体及びイチョウ葉由来テルペンラクトンには加齢によって低下する認知機能の一部である記憶力(日常生活で見聞きした情報を覚え、思い出す力)の精度や判断の正確さを向上させることが報告されています。これらの事から物事を忘れやすいと感じている中高年の方に適しています。』
性差による有効性の違いの例:
『本品には大豆イソフラボン(アグリコンとして)が含まれます。大豆イソフラボン(アグリコンとして)には骨の成分の維持に役立つ機能があることが報告されています。骨を丈夫に維持したい中高年女性の方に適した食品です。』
D.一般化されている評価方法で評価する必要が有る。
独自の評価方法では、妥当性や基準値の証明が非常に困難となります。
そのため病気では無い事がわかり、どのような状態かが分かる評価方法での臨床試験データが必要です。
その評価方法は一般化されている事が望ましく、一般化の明確な定義は有りませんが、以下のいずれかを充足していると良いと思われます。
・学会のガイドライン等に載っている。
・国(日本以外も可能)の食品局や医薬品局が定めた方法。
・測定方法が論文化されており、多くの論文で引用されている。
E.人種や生活様式による違いが無い事を考察する必要が有る。
現時点では、以下の説明に科学的に合致していれば受理されています(いつまでその方法で受理されるかは不明です)。
・日本人と栄養状態がほぼ同じ。飢餓状態は不適格。
・日本人と体格・筋力がほぼ同じ。筋力が強すぎるのは不適格。
・日本と気候が大きく離れていない。気温による代謝の違いは検討が必要。
・日本人と体質が大きく離れていない。評価指標に関わる代謝が体質により異なる場合は検討が必要。
F.機能性や対象者の限定がパッケージ・広告で適切に伝わるようにする。
届出者(メーカー様)の文字数を減らしてパッケージや広告で要点を強調したい気持ちは、消費者(購入者)の誤認に繋がってしまうため適切では有りません。
G.医薬的効能効果への接近・暗示は、受理後も撤回のリスクを伴うので避ける。
商品名やキャッチフレーズが受理されたから安心というわけではありません。
そのため、適切な表示を行う事が必要です。
H.作用機序も不十分であれば、受理後も撤回のリスクが伴うので適切に作成。
I.採用したものがSR(研究レビュー)とRCT(最終製品の臨床試験)かの明示して消費者の誤認を避ける。
J.表示文言に於いて効果の断定(言い切り)か補佐(助ける、サポート)かを明示して誤認を避ける。
採用した研究で測定しているものが直接指標または間接指標であるかを認識して資料を作成します。
L.届出した機能性のみ表示出来る(他の機能性は表示出来ない)。
記載して良いかどうかの話は別としまして、既存商品で多くの原材料とそれらによる機能性を記載されている商品があったとします。
こちらを機能性表示食品の届出を行いたい場合について、機能性表示食品の制度により機能性を表示できる部分もありますが、逆に減る部分もございます。
その場合、機能性表示食品として届出をしていない機能性は広告に使用できなくなります。
1つの商品で血圧抑制、食事血糖値抑制、疲労回復、記憶力維持・皮膚弾力性維持など多くを盛り込もうとしますと、各々の研究レビュー(機能性の書類)を準備する必要があります。研究レビューの作成費用などとの費用対効果から、1〜3ほどの機能性を盛り込むぐらいが現実的と思われます。(1つの商品に含まれる複数の材料で同じ機能性があると、どちらの材料で効いているかの証明が困難なため、その機能性での届出は避けた方が無難です)
また、薬機法(旧薬事法)などとの兼ね合いにより機能性表示食品として届出が出来ない機能性(ガン、リウマチ、アトピーなど)は記載から削除していただく必要があります。
M.原材料メーカー様から正当な許諾を得たうえで届出書類を使わせていただく方法も有る。
原材料会社さんが、「原材料の販売」と「届出書類の最も手間のかかる『研究レビュー』の正当な使用許諾」をセットにしてご提供される事があります。
それ以外の場合、つまり他社の研究レビューの丸写しは可能であるか?という質問をいただく事がございます。
丸写しは困難ですが、着想を得る程度であれば有効な場合がございます。
研究レビューについて、機能性表示食品の制度ではPRISMA(プリズマ、Preferred Reporting Items for Systematic Reviews and Meta-Analyses)声明というガイドラインに示された「こういう内容は記載してくださいね」という項目に沿って作成する事が望ましいですが、その書き方が統一されていない事から、丸写しによる著作権侵害は明らかに分かります。
ならば丸写しせずに必要な部分のみ転記しておき、合間を自分の言葉で埋めていけば丸写しでは無くなるかもしれません。しかし、写す元となった研究レビューに仮に誤りがあった場合、それまで転記してしまう恐れがあります。
その回避となりますと、研究レビューで採用した論文を取り寄せて内容を照らし合わせる必要があり、1から作成するよりも手間がかかる事もあります。そうなりますと研究レビューを初めから作成した方が著作権について安全ですし、更新(将来のメンテナンス)もしやすいです。
これらの事から、丸写しが分からないようにする工夫で生じるリスク・作業量を考えますと、既存の届出書類から「1日あたりの摂取目安量」と「採用する臨床試験論文」の着想を得る程度に留め、始めからオリジナルで作成した方が良いと思われます。
機能性表示の評価指標
膝関節の柔軟性・可動性
膝関節に関するアンケート結果(KOOS、JOA等)
→学会等で定められて一般化されたアンケートを使用する事により、解答を誘導するような作為的な研究になる事を避ける。
加齢によって低下する記憶力を維持する
記憶力に関するアンケート、筆記テスト
→学会等で定められて一般化されたアンケートを使用する事により、解答を誘導するような作為的な研究になる事を避ける。
脳血流
→脳血流は頭皮から赤外線を当てて計測する近赤外線トポグラフィーなどを使用。
目のコントラスト識別・光からの防御
コントラスト識別
→白黒の濃淡を入れた図の見え具合を視力測定のように測定。
光からの防御
→ブルーライトなどでダメージを受けて減ると言われている眼の中の黄斑(おうはん)という物質の量について、眼に光を当てて測定。
→血液検査にて黄斑に関連の有る物質の濃度(例:ルテイン)を測定。
お腹の脂肪を減らす
内臓脂肪、内臓脂肪
→X線CT画像のうち脂肪の面積を計算。撮影は絶食時間などの条件を揃える必要が有る。
体重を減らす
体重
→体重計による計測。一般的には体重の他に体脂肪率や血中脂質データも併せて評価する事が多いです。
中性脂肪の上昇を抑える
食後の中性脂肪
→採血により食前および食後30,60,90分などの中性脂肪の経時変化を短期的に確認する。
空腹時の中性脂肪
→採血により空腹時の中性脂肪を研究開始前と研究開始1,2,3ヶ月後などの経時変化を長期的に確認する。
血糖値の上昇を抑える
食後の血糖値
→採血により食前および食後30,60,90分などの血糖値の経時変化を短期的に確認する。
空腹時の中性脂肪
→採血により空腹時の血糖値を研究開始前と研究開始1,2,3ヶ月後などの経時変化を長期的に確認する。
整腸
排便回数・性状
→1日の排便回数、次の排便までに要する日数、1週間の排便日数の自己申告。
便性状
→バナナ、泥状、水状などの状態を自己申告
便量
→鶏卵やピンポン玉の大きさに換算して自己申告。
腸内細菌
→便に含まれる菌数・菌の種類の推移を確認。便は採取した瞬間に殺菌する事により、体外での変化を防止する。
コレステロール
HDLコレステロール
→採血により計測。俗にいう善玉コレステロールで、数値が高い方が良い。
LDLコレステロール
→採血により計測。俗に言う悪玉コレステロールで、数値は低い方が良い。
備考:総コレステロール(トータルコレステロール、T-cho)のみでの評価は困難である。
リラックス効果
交感神経と副交感神経のバランスの比
→心電図と血流のデータを微分して算出。
ストレスに関連するホルモン
→唾液や血液でIgAやコルチゾールなどを測定。
お肌の保湿
水分含有量
→表皮(ひょうひ:皮膚の表面)に含まれて居る水分量を通電により計測。
水分蒸散量
→表皮(ひょうひ:皮膚の表面)にから蒸散する水分量を温湿度計にて計測。
睡眠の改善
脳波
→頭皮に電極を貼り付けし、睡眠時に変化するアルファ派やベータ派等を機械で測定。
アンケート
→睡眠時間、寝起き状態に関するアンケートで評価。
疲労の改善
アンケート
→POMSと呼ばれる疲労に関するアンケート等を使用。
疲労物質
→血中の乳酸などを計測。
日常活動時の脂肪を代謝する力を高める
代謝測定
→代謝によって増加する呼気の二酸化炭素量を計測。
血圧
血圧
→安静時の血圧を計測。測定条件(環境、測定まえの活動量、心理状態)を厳密に揃える事が必要。
眼や鼻の不快感
血液指標
→眼や鼻の不快感に関連する血液指標を使用。その指標はアレルギー評価で用いられる事が多い。
免疫関連
血液指標とそれを裏付けるアンケート
→血液指標だけでなくアンケート結果との関連を示す必要が有る。
お問い合わせ内容を社内の皆様で共有されたい場合は、
ビデオ会議(Zoom、Teams、Google Meets)を用いてご説明させていただきます。
届出実績とサポートの種類
届出実績(補佐・代行)
機能性表示食品の届出(申請)で用いる機能性や安全性等の資料は、臨床試験の論文や食経験情報・動物試験等を基に作成します。
(株)機能食品研究所は食品CRO(開発業務受託機関、Contract Research Organization))として20年間(2004年〜)の臨床試験の受託と論文執筆の実績がございます。臨床試験の実績はこちらをご覧ください。
これらの経験を基に、御社商品の届出に最適な論文を国内外から幅広く収集してスコア化と考察を行う研究レビューを迅速丁寧に作成します。
また、機能性表示食品の届出で使用する食経験や安全性の説明資料の作成も円滑に行う事が可能です。
その理由は、臨床試験の受託業務での経験に有ります。臨床試験の実施前に倫理委員会による審査を受ける必要があり、安全性データ(食経験、細胞試験、動物試験など)を論文などから収集して書類を作成する技術の蓄積がございます。
弊社の届出サポートの実績は、機能性表示食品の制度開始から1年間(2015年4月〜2016年3月)に三重県の「食の機能性評価、相談窓口事業 (三重県健康福祉部) 」を受託して相談窓口の運営しました。
その次年度(2016年4月〜2017年3月)は、三重県の「食の機能性評価に関する専門家派遣事業 (三重県健康福祉部)」の相談員を担当しました。
これらの特徴・実績から多くのお客様のご愛顧いただき、約120件の補佐・代行をさせていただきました。
サポートの種類(補佐・代行)
補佐と代行をいつでも切り替え可能です
御社様の行われる作業の内容や比率によって、弊社の提供するサービスを以下の通り補佐と代行に分けております。
①補佐:御社様において届出書類の作成をされる場合は、補佐(支援、コンサルティング)をさせていただきます。
必要な部分のみ弊社の人材と知識を活用していただきますので、費用を安く抑える事が出来ます。
②代行:御社様にて届出書類の作成をされるお時間等が無い場合、弊社にて代行(受託)させていただきます。
最小限の内容(届出IDの発行、お客様相談室周辺の組織図作成等)を御社様にて行っていただくため、御社様の労力が軽減されます。
なお補佐(支援、コンサルティング)と代行(受託)のいずれも時間あたりの単価は同じでございます。そのため、作業にかかる時間が同じであれば合計金額は変わりません。
始めは補佐(支援、コンサルティング)のご指示をいただき、途中で代行(受託)に切り替えという方法もございます。いつでもお申し付けください。
但し、研究レビューは性質上、同一の研究者が一貫して作業を実施する必要が有ります。そのため計画書完成前の切り替えは容易ですが、計画書完成後の切り替えは作業が一部重複する事をご容赦願います。
適切な費用の計算を行います
機能性表示食品の届出(申請)にかかる費用は、「①実際の作業時間記録と、そこから計算した費用(作業時間×時間単価)」と「②外注費(文献取り寄せ費等)」の合算で算出しております。
特許や商標などとは違い、機能性表示食品の届出では国(消費者庁)への費用支払いは生じません。
具体的な算出方法ですが、まず予め適格な作業時間予定表をご提示して完成日等を明確に致します。
そして「①実際の作業時間記録と、そこから計算した費用(作業時間×時間単価)」と「②外注費」を定期的に提示し、品質を保ちながら適切な費用となるよう努めております。
この事により多くのお客様のリピート発注を戴いております。
最後までお読みいただき、ありがとうございました。
ご不明な点や費用等のご質問等ございましたら、先ずはお気軽にご連絡ください。
TEL/Mail/お問い合わせフォームはこちら




