機能性表示食品とは? その制度と種類、届出の流れ、注意点
(株)機能食品研究所
TEL:059-253-8091
E-mail:info@ksk-lab.co.jp
本社:〒514-0027三重県津市大門7-15
津センターパレス4F
研究室:〒514-8507津市栗真町屋町1577
三重大学 総合研究棟2 A棟4F
![]()
- 機能性表示食品の概要・特徴・届出の流れ
- 機能性表示食品とは?その制度と種類
- 保健機能食品の種類とそれぞれの特徴
- [制度説明①] 機能性表示食品の費用と届出までの期間
- 【参考】機能性表示食品制度のメリット・デメリット
- 機能性表示食品の制度と届出に必要な要件(申請・取得・受理までのポイント)
- 機能性の根拠の選択肢について
- 機能性表示食品の届出(申請・取得・受理)のプロセス
- [制度説明②] 特定保健用食品(特保、トクホ)の費用・期間について
- トクホのメリットとデメリット
- 特定保健用食品(トクホ)の概要
- [制度説明③] 栄養機能食品の費用・期間について
- 栄養機能食品のメリットとデメリット
- 栄養機能食品の制度と表示方法
- 栄養機能食品で表示可能な栄養成分と機能性の文言について
- 表示の重複禁止について
- 機能性表示食品の届出(申請)に必要な書類と作業工程
- 事前調査の流れ
- 機能性の根拠の書類作成 03〜08は研究レビューまたは臨床試験に分岐します
- 研究レビュー(SR、システマティックレビュー)とは
- 研究レビュー作成の流れ
- 届出書類作成の流れ
- 届出の流れ
- これらを事前に確認することで、差し戻しリスクを大幅に減らせます。
- 機能性表示食品の届出時の注意点まとめ
- 機能性表示の評価指標
- サポートの種類について
- 補佐と代行いずれもお任せください
- 食品、サプリメント、化粧品、ヘルスケア用品の臨床試験(ヒト試験、食品試験、皮膚試験、RCT)を実施
- 機能性表示食品の制度における臨床試験の利点
- 測定項目
- 臨床試験の流れ
- 機能食品研究所、7つの特徴
このページの目的
このページでは、制度の仕組みや届出までの流れ、費用の目安を、できるだけわかりやすくまとめています。
また、届出をスムーズに進めるためのポイントや、研究レビューと臨床試験の違いなど、
実際の準備や社内検討の場で役立つ内容もご紹介しています。
機能性表示食品とは、商品の機能性・安全性・製造等に関する資料等を消費者庁に届出し、届出番号が付与される制度です。
この機能性表示食品の届出書類作成や届出方法について、
「そもそも、どのような書類を準備すればよいか分からない」
「手元に材料の資料は有るのだけど、それが使えるかどうか判断したい」
「科学的な事は分かっているけど、届出に関する全体像を知りたい」
「機能性の根拠として提出する『研究レビュー』と『臨床試験』の違いを知りたい」。
研究レビューの作成について、
「そもそも、研究レビューとは何なのか分からない」
「手元に材料の論文は有るのだけど、それを活用出来るか判断したい」
「どんな機能性が有るかは分かっているけど、作成方法に関する全体像を知りたい」。
臨床試験の実施について、
「そもそも、臨床試験とは何なのかよく分からない」
「どのような手順や測定方法で行うのか知りたい」
「機能性表示食品の届出に使えるのか知りたい」。
このホームページはそのような方々へ向けて作成しました。
これらの情報が皆様の商品開発のお役に立てますと幸いでございます。
機能性表示食品の概要・特徴・届出の流れ
機能性表示食品とは?その制度と種類
「機能性表示食品」とは、科学的な根拠に基づいて健康機能を表示できる食品のことです。
この制度は、消費者庁が2015年4月に開始しました。
企業が自ら安全性や機能性のデータを整え、消費者庁に届け出て「受理」されることで、
その食品の健康への働きを商品パッケージなどに表示することができます。
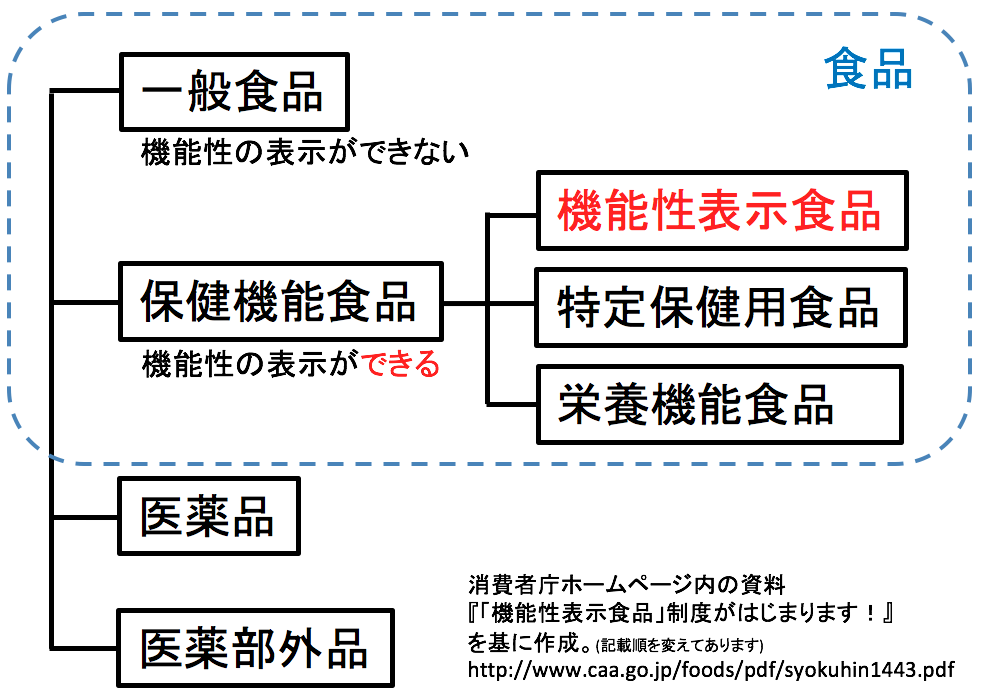
食品は大きく「一般食品」と「保健機能食品」に分けられます。
このうち、保健機能食品は国の制度として認められており、
健康の維持や増進に役立つ機能を表示できるのが特徴です。
一般食品:体によい働きがあっても、健康機能をパッケージなどに表示することはできません。
保健機能食品:国が制度として認めており、体によい働き(=機能性)を表示できます。
保健機能食品には、次の3つの制度があります。
機能性表示食品(2015年開始)
届出を行い、消費者庁に受理されれば販売が可能です。特定保健用食品(特保・トクホ)(1991年開始)
企業が独自に行った試験結果などをもとに、消費者庁の審査を受けて許可されます。栄養機能食品(2001年開始)
届出や申請は不要で、ビタミン・ミネラルなどの栄養成分について、定められた表現で機能を表示できます。
保健機能食品の種類とそれぞれの特徴
保健機能食品には、3つの制度があります。
それぞれ届出・審査・表示の条件が異なるため、製品の目的や開発の段階に応じて、どの制度を選ぶかがとても重要です。
①機能性表示食品
企業が事前に消費者庁へ届出を行うことで、健康機能を表示できる制度です。
届出が「受理」されると販売が可能になります。
ただし、販売後も定期的な情報の更新やリスク管理が必要です。
②特定保健用食品(特保、トクホ)
企業が自ら実施した試験によって食品の効果を証明し、
消費者庁の審査と許可を受けて初めて販売できる制度です。
科学的な根拠が特に重視されるため、信頼性の高い制度ですが、
開発や審査にかかる費用・期間・リスクが比較的大きい点が特徴です。
③栄養機能食品
ビタミンやミネラルなどの栄養成分について、
一定の基準量を満たしていれば、届出をせずに機能を表示できる制度です。
表示にはルールが定められており、規定どおりの成分量を含んでいることが条件となります。
このように、保健機能食品にはそれぞれ特徴が異なります。
商品の目的や開発状況に合わせて、最も適した制度を選び、仕組みを正しく理解することが大切です。
[制度説明①] 機能性表示食品の費用と届出までの期間
企業様からよくいただくご質問のひとつが、
「機能性表示食品の届出にはどのくらいの費用がかかるのか?」という点です。
費用の中心となるのは、研究レビュー(SR)の作成や臨床試験の実施に関わる部分です。
一般的な目安として、研究レビュー方式では約400万〜700万円程度、
臨床試験を伴う場合は3,000万円を超えるケースもあります。
詳細な見積りは、無料でご案内が可能です。
→ お問い合わせはこちら
詳細は無料でお見積り可能です。
→ お問い合わせはこちら
【機能性表示食品】の費用・期間・流れ
費用の目安
届出の方法によって、必要な費用は大きく異なります。
新しく研究レビューを作成する場合
使用する論文の量や内容によって異なりますが、おおよそ400万〜700万円が目安です。既存のレビューやデータを活用する場合
原材料メーカーなどがすでに作成したレビューや安全性情報を活用できる場合は、
50万〜100万円程度に抑えることも可能です。
期間の目安
届出完了までの期間も、選ぶ方法によって異なります。
既存の臨床試験データをもとに研究レビューを作成する場合
届出から販売開始までの期間は約7〜11ヶ月が目安です。新たに臨床試験を実施する場合
試験の計画・実施・論文化まで含めると、**48〜72週間(約12〜18ヶ月)**を要します。
当社のサポート内容
株式会社機能食品研究所では、
機能性表示食品の届出に必要な研究レビューの作成や届出書類の整備を、経験豊富な専門スタッフが丁寧にサポートいたします。
研究レビューでは、信頼性の高い臨床データや公的情報をもとに、
機能性と安全性をわかりやすく整理し、消費者庁への届出を円滑に進めます。
このような取り組みにより、
届出された製品が市場で信頼される品質を持ち、競争力のある商品として認知されやすくなることを目指しています。

【参考】研究レビューと臨床試験、どちらを選ぶべきか
機能性表示食品の届出を行う際には、
製品の機能性を裏付けるための科学的根拠が必ず必要です。
この根拠を示す方法には、主に次の2つがあります。
1. 研究レビューを活用する方法
既存の信頼できる論文やデータをもとに、
製品の機能性を整理・評価する方法です。
研究レビューは、おおよそ2〜4週間で作成可能で、
比較的短期間で届出の準備を整えられるのが大きな特長です。
2. 新たに臨床試験を実施する方法
製品そのものを対象に臨床試験を行い、
独自の科学的データを取得する方法です。
ただし、この場合は**約48〜72週間(およそ12〜18ヶ月)**と長期間を要し、
費用やリスクも大きくなります。
実際の選ばれ方
実際には、機能性表示食品の約9割が研究レビュー(SR)による届出手法を採用しています。
新規の臨床試験を実施するケースはごく一部にとどまります。
必要な準備期間やコスト、製品の開発段階に応じて、
どちらの方法を選ぶかを慎重に検討することが重要です。
【参考】機能性表示食品制度のメリット・デメリット
メリット
機能性表示食品の届出は、届出から受理までの期間が比較的短いことが大きな利点です。
通常はおよそ7〜11ヶ月で完了します。
また、手続きに必要な書類も他の制度に比べて少なく、
初めて取り組む企業様でもスムーズに進めやすいという特徴があります。
デメリット
一方で、この制度は「許可制」ではなく「届出制」であるため、
消費者庁は内容の真偽を審査せず、形式的な確認のみを行います。
そのため、届出後に第三者から内容の指摘を受け、修正を求められる場合があります。
販売開始後も情報の更新やリスク管理を継続して行うことが重要です。
このように、機能性表示食品制度は「スピード」と「柔軟性」に優れる一方で、
届出内容の正確性と継続的な管理が企業の責任となる点を理解しておくことが大切です。
機能性表示食品の制度と届出に必要な要件(申請・取得・受理までのポイント)
この制度は2015年4月に施行されました。
企業が自ら安全性と機能性の根拠を整理し、消費者庁に届け出て受理されることで、
特定保健用食品(トクホ)と同じように健康機能を表示することが可能になります。
ただし、この制度は「審査制」ではなく**「届出制」であるため、
表示内容の正確性や根拠に関する最終的な責任は企業にあります。**
制度の特徴
機能性表示食品は、特定保健用食品(トクホ)に比べて
届出までの期間が短く、費用を大幅に抑えられることが最大のメリットです。
一方で、消費者庁からの「受理」後も、
情報の更新やリスク管理を継続して行う必要がある点には注意が必要です。
届出に必要な書類
届出は電子申請方式で行い、以下の5種類の書類をPDF形式で提出します。
構成は次のとおりです。
① 安全性 ② 品質管理 ③ 健康被害対応 ④ 機能性の根拠 ⑤ 表示内容
① 安全性の根拠
日本国内での食経験や、安全性試験の結果をまとめたものです。
② 生産・製造および品質の管理
製造工場の情報、栄養成分や機能性関与成分の分析方法、その結果を記載します。
③ 健康被害の情報収集体制
消費者からの問い合わせ窓口、また万が一問題が発生した際の社内対応フローを示します。
④ 機能性の根拠
健康な成人を対象とした臨床試験の結果、または関連する論文をまとめた**研究レビュー(SR)**を提出します。
⑤ 表示の内容
商品のパッケージや広告に記載する機能性表示文言やデザイン案などを添付します。
このように、届出に必要な要件は多岐にわたりますが、
安全性・機能性・品質・表示内容を総合的に整えることが、受理への大切な第一歩となります。
機能性の根拠の選択肢について
機能性表示食品の届出を行う際には、
その食品の機能性を証明するための科学的根拠を提出する必要があります。
この科学的根拠の示し方には、主に次の2つの方法(またはその併用)があります。
A. 最終製品を用いた臨床試験結果(ヒト試験)
実際の最終製品を被験者に摂取してもらい、
有効性と安全性を検証する方法です。
この試験結果は、査読付きの学術論文として公表されていることが求められます。
論文として公開されることで、研究の信頼性と透明性が保証されます。
B. 機能性関与成分に関する研究レビュー(システマティックレビュー:SR)
既存の複数の臨床研究データを統合・分析し、
成分レベルでの機能性を科学的に評価する方法です。
システマティックレビューは、既存の科学的知見を体系的に整理して結論を導く手法であり、
比較的短期間で届出準備を進められる点も特徴です。
このように、届出では「製品そのものを試験で確認する方法」と
「成分の科学的エビデンスを整理して示す方法」が選択肢となります。
どちらを選ぶかは、製品の開発段階・コスト・スケジュールを踏まえて判断することが重要です。
機能性表示食品の届出(申請・取得・受理)のプロセス
機能性表示食品の届出は、消費者庁に対して電子ファイル形式で必要書類を提出する形で行います。
この届出によって、製品の安全性や機能性、表示内容などを確認してもらい、「受理」されることで販売が可能になります。
提出が必要な主な書類
届出の際には、次のような資料をPDF形式で準備します。
栄養成分の分析結果
機能性関与成分の分析結果と分析手順
製造設備に関する情報(認証番号・所在地など)
商品パッケージのデザイン案
会社の組織図および、健康被害などの有害事象が発生した際の対応フローチャート
弊社のサポート内容
株式会社機能食品研究所では、以下の書類作成を中心にサポートしています。
製品の機能性を裏付ける科学的根拠の整理・作成
安全性情報や作用メカニズムに関する説明書類の作成
届出に必要な各種書類の作成支援
これらの資料を一貫して整えることで、届出の手戻りを防ぎ、スムーズな受理につなげます。
届出のスケジュール目安
書類作成期間: 約1ヶ月
届出から消費者庁による受理まで: 約6〜12ヶ月(60営業日を含む)
届出を円滑に進めるためには、事前の調査とスケジュール管理がとても重要です。
準備段階で必要な資料の有無を早めに確認しておくことで、受理までの期間を短縮できます。
[制度説明②] 特定保健用食品(特保、トクホ)の費用・期間について
費用について
特定保健用食品(トクホ)の開発には、広範囲にわたる研究と長期的な検証が必要です。
一般的には、開発開始から許可取得までに約3年〜10年を要するとされています。
主な流れは次のとおりです。
作用機序の解明(1か月〜数年)
消化・吸収・代謝・排泄の経路や、分子レベルでの作用を明らかにします。
既存の論文を引用することも可能ですが、情報が不足している場合は新たな研究が必要となります。安全性試験(動物試験・ヒト試験)(1〜2年)
動物およびヒトを対象に、安全性を確認します。
単回投与、数か月の反復投与(通常量および過剰量)、半年〜1年の長期投与など、複数の試験を行います。遺伝毒性試験(約半年)
細胞や微生物を用いて、奇形や遺伝子への影響がないかを確認します。用量設定試験(ヒト試験)(約1年)
低用量・中用量・高用量を設定し、適切な摂取量を検討します。機能性評価試験(ヒト試験)(約1年)
設定した用量をもとに、実際に機能性を確認する臨床試験を行います。消費者庁への申請・審査
これまでの試験結果をもとに申請を行い、複数回の質疑応答を経て審査が進められます。
これらの研究や試験は多岐にわたるため、
総費用は1億円から2億円程度にのぼることがあります。
期間について
作用機序の研究から安全性・有効性の確認、そして消費者庁への申請・許可まで、
一連の流れにはおよそ3年〜10年という長い期間を要します。
このように、特定保健用食品は高い信頼性を得られる反面、
開発にかかるコストと時間の負担が大きい制度であることが特徴です。
トクホのメリットとデメリット
メリット
特定保健用食品(トクホ)は、科学的根拠に基づく厳格な審査を経て許可される制度です。
そのため、消費者や取引先からの信頼性が非常に高いという特徴があります。
また、長年にわたり運用されている制度であり、
「トクホマーク」がパッケージに表示されることで高いブランド認知と安心感を得られます。
第三者からの指摘やトラブルも少なく、制度としての安定性があります。
一方、機能性表示食品の届出では、消費者庁は書類の形式的な不備のみを確認し、
内容の真偽は評価しません。表示内容の責任はすべてメーカー側にあります。
その点で、**トクホは国による審査・許可を受けた“信頼の証”**といえます。
デメリット
一方で、特定保健用食品は開発に長い期間(約3〜10年)を要し、
試験や審査にかかる費用も非常に高額になります。
また、消費者の中には機能性表示食品とトクホの違いが分かりにくいという声もあり、
費用対効果の面で課題となる場合があります。
さらに、機能性表示食品では表現の自由度が高いため、
内容によっては機能性表示食品のほうが訴求力を持つケースもあります。
こうした状況を「逆転現象」と呼ぶことがあります。
このように、特定保健用食品(トクホ)は信頼性とブランド価値が高い一方で、
時間とコストの負担が大きく、制度上の柔軟性が低い点が課題となります。
特定保健用食品(トクホ)の概要
特定保健用食品(トクホ)は、1991年に制度が施行された、約30年の歴史を持つ制度です。
関与成分を含む食品に対して、作用機序の解析や動物・ヒトを対象とした安全性試験を実施し、
その科学的根拠をもとに消費者庁の厳しい審査と許可を受けて初めて販売が認められます。
この制度により、血圧・血糖値・体脂肪・中性脂肪・整腸などの健康機能について、
具体的な表現で表示することが可能です。
たとえば、次のような表示が認められています。
「食後の血糖値が気になる方に適しています」
「おなかの調子を整えるのに役立ちます」
このように、特定保健用食品(トクホ)は、国による審査と許可を経て機能性を表示できる唯一の制度であり、
長年にわたり消費者から高い信頼を得ています。
[制度説明③] 栄養機能食品の費用・期間について
費用について
栄養機能食品は、消費者庁への届出や申請が不要な制度です。
そのため、主に行うのは栄養成分の分析であり、外部機関に依頼する場合の費用はおよそ2万〜3万円程度が一般的です。
当社(株式会社機能食品研究所)では、この分野に関する分析支援やコンサルティングも行っています。
一度のサポートを通じて、企業様が自社で今後も対応できるようにノウハウを蓄積することを目指しています。
期間について
栄養成分の分析は、通常2〜3週間程度で完了します。
機能性表示食品や特定保健用食品と比べると、手続き・費用・期間の負担が非常に小さい制度であり、
まず最初に取り組みやすい保健機能食品の一つです。。
栄養機能食品のメリットとデメリット
メリット
栄養機能食品は、消費者庁への届出や申請が不要なため、
手続きが非常にシンプルで、スピーディーに販売まで進められる点が大きな特徴です。
また、ビタミンやミネラルなど、すでに効果が科学的に認められている成分を扱うため、
制度上のリスクが少なく、安心して導入しやすいこともメリットです。
デメリット
一方で、対象となる栄養成分は20種類に限定されています。
また、表示できる機能性の表現もあらかじめ決められており、
自由な文言や多様な訴求表現を行うことはできません。
表示文言は国が定めた統一された形式に従う必要があり、
他社との差別化を図ることが難しい点が課題となります。
このように、栄養機能食品は「簡便さと安心感」が大きな強みである一方、
表現の自由度や商品独自性には制約がある制度といえます。
栄養機能食品の制度と表示方法
栄養機能食品は、国が定めた規格基準に基づく制度です。
対象となる栄養成分が、製品の1日の摂取目安量に含まれており、
その量が国の定める上限値と下限値の範囲内にある場合、
製品パッケージなどで機能性を明確に表示することができます。
表示文言は、あらかじめ国が定めた形式に従う必要があり、
例えば「カルシウムは骨や歯の形成に必要な栄養素です」など、
成分ごとに統一された表現を使用します。
このように、栄養機能食品はシンプルな手続きで信頼性のある表示ができる制度であり、
安全性と明確なルールのもとで運用されています。

栄養機能食品で表示可能な栄養成分と機能性の文言について
栄養機能食品では、国が定めた特定の栄養成分が対象となり、
それぞれに「1日あたりの摂取目安量」と「表示できる機能性の文言」が明確に定められています。
これらの文言は、国の定めた表現を一言一句そのまま使用する必要があり、
変更や省略は認められていません。
以下に、主な対象成分と摂取目安量、および機能性文言をまとめます。
■脂肪酸
- N-3系脂肪酸(0.6〜2.0g/day):皮膚の健康維持を助ける。
■ミネラル類
- 亜鉛(2.64〜15.00mg/day):味覚を正常に保つ。皮膚や粘膜の健康維持。たんぱく質・核酸の代謝に関与して健康の維持に役立つ。
- カリウム(840〜2,899mg/day):正常な血圧を保つ。
- カルシウム(204〜600mg/day):骨や歯の形成に必要。
- 鉄(2.04〜10mg/day):赤血球を作るのに必要。
- 銅(0.27〜6.0mg/day):赤血球の形成を助ける。多くの体内酵素の正常な働きとエネルギー産生を助けるとともに、血液循環を正常に保つのに必要。
- マグネシウム(96〜300mg/day):骨や歯の形成に必要。多くの体内酵素の正常な働きとエネルギー産生を助けるとともに、血液循環を正常に保つのに必要。
■ビタミン類
- ナイアシン(3.9〜60.0mg/day):皮膚や粘膜の健康維持を助ける。
- パントテン酸(1.44〜30.00mg/day):皮膚や粘膜の健康維持を助ける。
- ビオチン(15〜500μg/day):皮膚や粘膜の健康維持を助ける。
- ビタミンA(231〜600μg/day):夜間の視力の維持を助ける。皮膚や粘膜の健康維持を助ける。
- ビタミンB1(0.36〜25.00mg/day):炭水化物からのエネルギー産生と皮膚や粘膜の健康維持を助ける。
- ビタミンB2(0.42〜12.00mg/day):皮膚や粘膜の健康維持を助ける。
- ビタミンB6(0.39〜10.00mg/day):たんぱく質からのエネルギー産生と皮膚や粘膜の健康維持を助ける。
- ビタミンB12(0.72〜60.00μg/day):赤血球の形成を助ける。
- ビタミンC(30〜1000mg/day):皮膚や粘膜の健康維持を助けるとともに、抗酸化作用を持つ。
- ビタミンD(1.65〜5.00μg/day):腸管でのカルシウム吸収を促進し、骨の形成を助ける。
- ビタミンE(1.89〜150mg/day):抗酸化作用により、体内の脂質を酸化から守り、細胞の 健康維持を助ける。
- ビタミンK(45〜150μg/day):正常な血液凝固能を維持する。
- 葉酸(72〜200μg/day):赤血球の形成を助ける。胎児の正常な発育に寄与する。
表示の重複禁止について
栄養機能食品、機能性表示食品、特定保健用食品(トクホ)、特別用途食品は、
それぞれが異なる制度に基づく食品カテゴリーです。
これらの制度間では、同じ機能性を重ねて表示することは認められていません。
たとえば、ひとつの製品で「機能性表示食品」と「栄養機能食品」の両方の表示を同時に行うことはできません。
法的根拠
このルールは、消費者庁が定める
『食品表示基準について』(平成27年3月30日・消食表第139号)
に明記されています。
また、詳細は消費者庁ホームページの「食品表示」セクション内にある
「食品表示一元化情報」ページでも確認できます。
以下の食品については、機能性表示食品の対象から除くこととする。
①特別用途食品及び栄養機能食品
消費者が製品を選択する際、複数の機能性表示制度に基づく表示が記載されていると、それぞれの記載がいずれの制度に基づく表示であるのか混乱を招くおそれがある。当該混乱を防止するため、また、各制度の趣旨の違いに鑑み、従来の機能性表示制度に基づく食品(特定保健用食品と栄養機能食品)及び特定保健用食品を除く特別用途食品との併用は認められない。
このように、各制度はそれぞれ目的と運用ルールが異なるため、
一つの製品につき、一つの制度表示のみが可能となっています。
制度の正しい使い分けを理解することが、
表示トラブルを防ぎ、消費者からの信頼を得るために重要です。
機能性表示食品の届出(申請)に必要な書類と作業工程
届出に必要な5種類の書類
機能性表示食品の届出には、次の5種類の書類を準備する必要があります。
これらの資料は、届出工程の中核を担う最も重要な提出書類です。
① 安全性の根拠
日本国内での食経験や、動物・ヒトを対象とした安全性試験の結果をまとめた資料です。
② 生産・製造および品質の管理
製造工場の情報や、栄養成分・機能性関与成分の分析方法、その結果などを記載します。
③ 健康被害の情報収集体制
消費者からの問い合わせ対応、健康被害発生時の社内報告・対応体制を示す資料です。
④ 機能性の根拠
製品の機能性を裏付ける科学的根拠を示します。
この項目では、以下の2つの方法から選択、または併用が可能です。
最終製品または機能性関与成分に関する研究レビュー(SR:システマティックレビュー)
最終製品を用いた臨床試験の結果(査読付き論文として公表されているもの)
⑤ 表示の内容に関する情報
製品パッケージや広告に記載する機能性表示文言・デザイン案などを添付します。
機能性表示食品の届出には、以下の5種類の書類が必要です。
これら5種類の書類を正確かつ整合性のある形で準備することが、
届出のスムーズな受理と、信頼性の高い情報開示につながります。
機能性の根拠の選択肢
機能性表示食品の届出では、製品の機能性を科学的に証明する根拠として、
次のいずれか、または両方を組み合わせて提出することができます。
① 最終製品または機能性関与成分に関する研究レビュー
(SR:システマティックレビュー)
既存の信頼性の高い論文や臨床試験データを収集・整理し、
機能性関与成分や最終製品の効果を総合的に評価する方法です。
短期間で届出準備が整うため、現在の届出全体の約9割がこの方式を採用しています。
② 最終製品を用いた臨床試験の結果
実際の製品を被験者に摂取してもらい、その有効性と安全性を確認する方法です。
この場合、査読付きの学術論文として公表されているデータのみが認められます。
独自性の高いエビデンスを得られる反面、期間とコストの負担が大きくなります。
これら2つの方法は、機能性表示食品の届出において
**最も重要な「科学的根拠の中核」**を構成する部分です。
どちらの方法を選ぶかは、製品の開発段階・目的・スケジュールに応じて判断します。
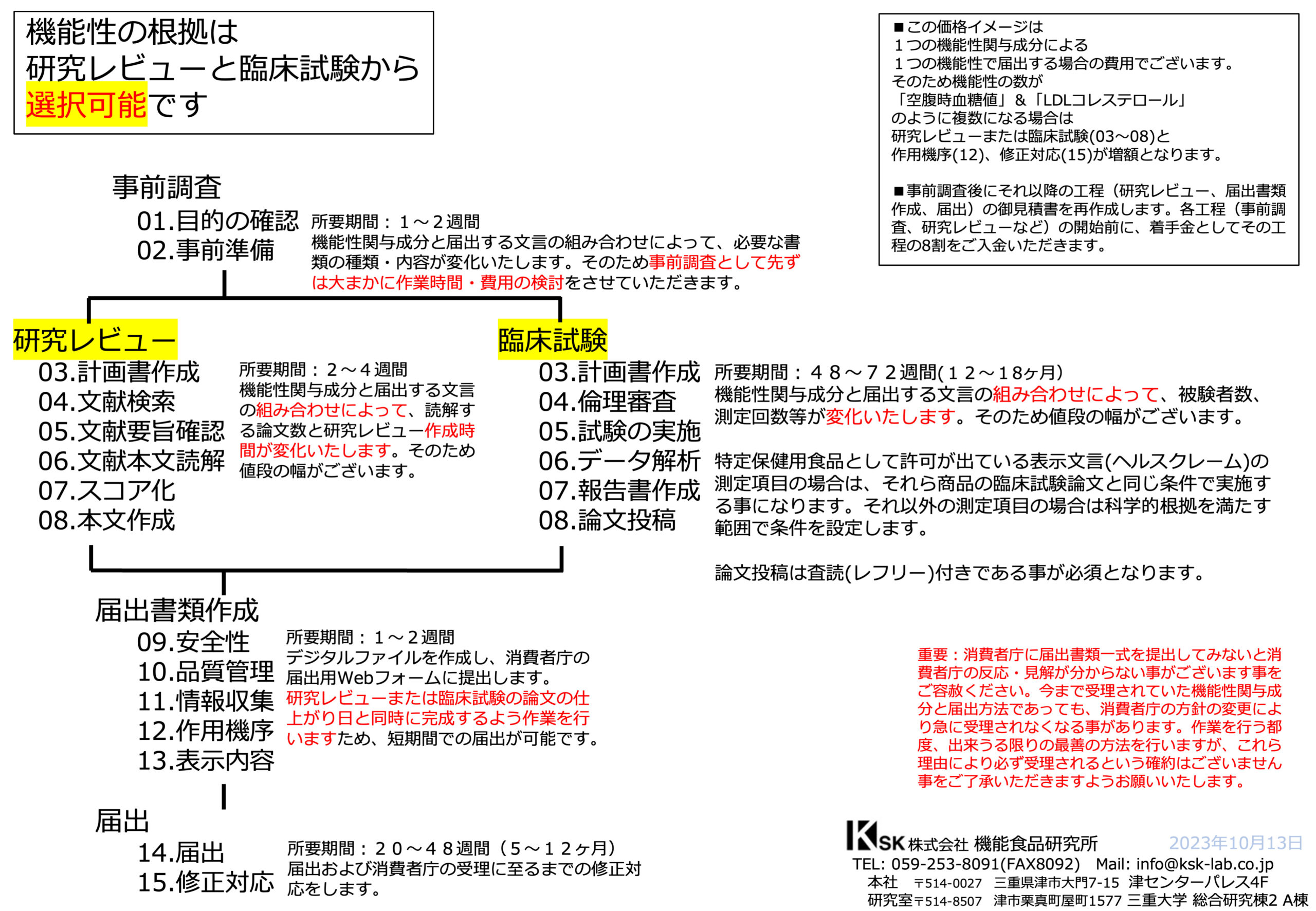
届出の作業工程(15段階)
株式会社機能食品研究所では、機能性表示食品の届出(申請)を、
全15のステップに細分化して一貫管理しています。
この工程管理により、書類の整合性や提出スケジュールを正確に把握し、
届出の受理までを効率的かつ確実に進めることが可能です。
主な工程の区分
事前調査(01〜02)
原料情報や臨床エビデンスの確認、制度適合性の判断などを行います。届出書類の作成(09〜13)
安全性・機能性の根拠整理、品質管理情報、表示内容の設計など、
届出の中核となる文書を整えます。届出提出と受理対応(14〜15)
電子申請による提出後、消費者庁からの確認や修正依頼への対応を行い、
最終的な「受理」通知を得て完了します。

事前調査の流れ

所要期間:1〜2週間
届出(申請)の際には、機能性関与成分と届出文言の組み合わせにより、必要な書類の種類や内容が異なります。
安全性資料や機能性の臨床試験論文の必要数が大きく変動することがあります。
臨床試験論文がない場合は新たに臨床試験を実施する必要があり、事前調査で目的を確認し、準備にかかる作業時間を検討することが重要です。
既存の表示文言(ヘルスクレーム)の場合:
事前にどのような評価項目や測定値の変動があれば受理されるかの目安があります。これにより、事前調査で予想される問題点を把握できます。
新しい表示文言(ヘルスクレーム)の場合:
消費者庁からの差し戻し理由を事前に推測するのは難しく、初回届出後の差し戻しを経て問題点が明らかになることがあります。この点についてご了承をお願いいたします。
機能性表示食品の届出に関する事前調査は約2週間で行い、その間に3回のWeb会議を実施します。
最初の会議では、希望する表示文言(ヘルスクレーム)と関連資料の提出をお願いし、次の会議で機能性関与成分の大まかな含有量を共有し、最終会議で調査結果を報告します。
各段階での詳細な情報提供と決定をお願いし、最終的な表示文言(ヘルスクレーム)の選定をいたします。
■初回Web会議(事前調査の開始打ち合わせ、60分)
この会議では、御社から希望するヘルスクレーム1〜2件をご提出いただくようお願いします。また、可能であれば、その機能性や安全性に関する資料の提供もお願いします。会議中には、弊社が次の2週間で行う工程について詳しく説明します。
↓
■第2回Web会議(事前調査の中間報告、60〜120分)
この会議では、御社の商品に含まれる機能性関与成分の含有量(大まかな量で結構です)をお知らせください。弊社からは、各ヘルスクレームの難易度、必要期間、および概算費用について説明します。会議中に、次回の打ち合わせまでに焦点を当てるヘルスクレームを1つに絞るか、または2つを継続するかの判断をお願いします。
↓
■第3回Web会議(事前調査の結果報告、60〜120分)
この会議で御社が資料を準備する必要はありません。弊社からは事前調査の結果を報告し、その内容をパワーポイントスライドでメールにて送付します。会議の日程終了後、進めるヘルスクレームを選定していただくことになります。
01.目的の確認
目的をヒアリング
まずは、お客様の目的を明確にするために、メール・お電話・Web会議などを通じてヒアリングを行います。主に以下の内容をお伺いします:
使用を予定している機能性関与成分は何か
表示を希望される機能性の文言(ヘルスクレーム)はどのようなものか
発売希望時期はいつ頃か
機能性関与成分の機能性・安全性に関するお手持ちの資料がある場合、その種類と内容
Web会議を用いて制度をご説明
機能性表示食品の開発・発売にあたっては、御社内のさまざまなご担当者が関わることになります。
そのため、全体の制度概要や各書類の位置づけについて、Web会議を通じて丁寧にご説明いたします。
各書類と主なご担当部門の例は以下の通りです:
安全性の根拠:開発・研究ご担当者様
生産・製造および品質の管理:工場・生産部門ご担当者様
健康被害の情報収集体制:お客様相談室ご担当者様
機能性の根拠:開発・研究ご担当者様
表示の内容:営業・広報、デザイン・企画ご担当者様
社内で多くのご担当者が関わる場合の課題と対応
機能性表示食品の届出には、開発・製造・品質管理・お客様対応・営業・広報など、複数の部署が関わることが一般的です。
そのため、以下のようなお困りごとが生じるケースも少なくありません:
社内の各担当者に「こう書いてください」と説明して回る時間が必要になる
一日中、あちこちから届出書類の書き方に関する質問が寄せられ、自分の作業が中断される
部署間の縦割りの関係により、他部署への依頼や説明に気を遣うことが多い
このようなお困りごとを解消するために、必要に応じてZoomやTeamsなどのWeb会議ツールを使って、機能性表示食品制度の全体像や役割分担についてご説明いたします。
ご説明は以下の内容を中心に、30分程度で要点を簡潔にお伝えします。
皆様ご多忙の中でも参加しやすいよう、効率的な内容構成を心がけております。
既存の制度との違いについて(機能性表示食品、特定保健用食品(特保)、栄養機能食品)
どのような機能性を表示できるかの例
対象商品となるかの判断方法について
安全性の根拠の書類で必要な情報について
生産・製造及び品質の管理の書類で必要な情報について
健康被害の情報収集体制の書類で必要な情報について
機能性の根拠の書類で必要な情報について
商品パッケージに表記する必要のある情報について
ビデオ会議にご参加いただいた皆様のご感想
制度説明のWeb会議にご参加いただいた方々から、以下のようなご感想を頂戴しております。
「噛み砕いた説明で分かりやすく、短時間で制度の全体像を把握できました。」
「取引先に『いま機能性表示食品を目指しています』と安心して話せるようになりました。これまでは詳しい説明ができるか不安でしたが、自信をもって答えられそうです。」
「社内にたくさんアイデアを提案できそうです。制度の全体像が見えていなかった時は、『本当に進めていいのか?』や『あとから大きな壁にぶつかるのでは?』と不安でしたが、前向きになれました。」
このように、制度の理解が深まることで社内外のコミュニケーションが円滑になり、プロジェクトの推進力も高まったとのお声を多くいただいております。
02.事前準備
情報の確認、探索、検討
目的の確認が完了した後、弊社にて以下の事前準備を進めます。
機能性関与成分に関する機能性や安全性の資料をお持ちの場合は、その種類と内容をお知らせください。
いただいた情報の有無に応じて、以下のいずれかの対応を行います。
パターン1:お客様から資料をご提供いただく場合
(一部の情報のみのご提供でも結構です)
機能性資料の確認
ご提供いただいた論文の要旨や図表を簡易に読み解き、機能性関与成分の理解を深めます。安全性資料の確認または予備探索
副作用や医薬品との相互作用など、安全性に関する情報をチェックします。今後の論文検索にも役立てます。関連論文の予備検索
ご提供資料に加え、該当成分に関する邦文・英文の論文がどの程度あるかを把握し、研究レビュー作成に必要な作業量を大まかに見積もります。追加論文の簡易読解(必要に応じて)
ご提供いただいた資料で十分な場合は、この工程を省略します。
パターン2:弊社にて資料の探索を行う場合
安全性資料の予備探索
副作用や相互作用など、安全性に関する文献情報を収集します。機能性関連論文の予備検索
邦文・英文の論文を対象に題名・要旨を検索し、該当分野の研究の厚みや分量を確認します。論文内容の簡易読解
抽出された文献の要旨や図表を確認し、研究レビュー作成に向けた情報整理を行います。
このように、事前段階から効率的に方向性を定めることで、研究レビュー作成の精度とスピードを高めてまいります。
そして、上記の事前調査結果を基に、以下の3点を整理・明文化してまいります。
事前調査結果の整理・明文化
事前調査の結果を踏まえ、以下の3点について整理し、文書化いたします。
A.届出に必要な作業内容とその流れ
本商品の機能性関与成分で届出を行うために必要となる主な作業内容を具体的に洗い出し、その工程の流れを明確にします。
B.各作業工程にかかる作業時間の見込み
各工程ごとに必要となる概算の作業時間を提示し、スケジュール立案の参考といたします。
C.想定される課題やリスク
届出を進める上でのネックやリスクを、事前情報に基づき明確にし、対応策検討の材料とします。
A.この商品の機能性関与成分で届出を行うには、どのような作業が必要か?
届出に必要な主な作業内容について、以下の5項目それぞれで「どのような書類を」「どのような資料を用いて」作成するかのイメージを整理します。
安全性の根拠
国内外での食経験や安全性試験の有無などをもとに、関連資料を精査・活用します。生産・製造および品質の管理
製造施設の認証情報(GMP、ISOなど)や成分分析結果・分析方法に関する資料を確認し、必要な様式に落とし込みます。健康被害の情報収集体制
社内体制(組織図やフローチャート等)をもとに、消費者対応の流れを示した資料を作成します。機能性の根拠(研究レビューまたは臨床試験)
既存の論文やデータを基に研究レビューを作成、必要に応じて新たに臨床試験を設計・実施します。表示の内容
パッケージのデザイン案や記載文言を確認・調整し、法令上の必須記載内容に沿って整理します。
B.各作業工程にかかる予想時間はどの程度か?
上記Aの各項目について、作成にかかるおおよその時間を推定します。
特に時間に影響を与える主な要因は以下の通りです。
安全性の根拠に使用する資料の量と種類
**機能性の根拠(研究レビューまたは臨床試験)**に用いる論文数、または臨床試験の有無と規模
なお、機能性の根拠について補足します。
既存論文を用いた研究レビュー作成は、文献収集・読解が中心となるため約4〜8週間で完了可能です。
一方、新たに臨床試験(ヒト試験・食品試験)を実施する場合は、試験設計・実施・摂取期間・論文化まで含め、**48〜72週間(約12〜18ヶ月)**を要するケースがあります。
この差は届出の受理や商品発売時期に大きく影響するため、重要な検討ポイントとなります。
C.ネックとなると予想される問題はあるか?
事前調査の段階で判明したネックやリスクについては、その時点で想定される解決策や対応方針を報告します。
また、研究レビューや届出書類の作成中、あるいは届出後に新たな問題が発生することもあります。
その際は適宜ご相談しながら対応方針を決定していきますので、ご理解のほどお願い申し上げます。
事前調査報告書の提出について
これまでに実施した「01 目的の確認」および「02 事前準備」の内容をもとに、事前調査報告書を作成いたします。
本報告書はPowerPoint形式で作成し、メールにて納品させていただきます。
報告書に含まれる内容
研究レビューおよび届出書類全般の作成にかかると予想される作業工程と所要時間
各工程の時間見積もりの根拠および、使用する資料の概要
今後の工程において必要となる作業内容と、その想定所要時間
※作業時間は、進行状況や追加資料の有無等により前後する可能性がございます。あらかじめご了承ください。
本報告書は、今後の作業を社内で実施されるか、外部委託を検討されるかの判断材料としてもご活用いただけます。
事前調査報告書(サンプル構成)について
当社では、機能性表示食品の届出をご検討されている企業様向けに、「事前調査報告書」をご提供しております。
これは、研究レビューの作成や届出に必要となる作業内容・工数の見通しを、PowerPoint形式の資料にまとめたものです。
📄報告書の主な構成(全8項目)
表紙
調査対象商品名、提出日、提出者情報などを記載。調査の目的と背景
届出制度の概要、ご依頼内容、参考とした既存の届出番号などをまとめます。調査フローと進捗状況
文献検索、評価、レビュー執筆、届出書類作成の全体工程と、現在の進捗を図解で示します。工程①:目的の設定
表示文言の方向性(例:腸内環境・体脂肪)を検討した内容と、作業時間の目安を記載します。工程②〜④:文献検索〜レビュー執筆
・文献検索の方法と記録の取り方
・論文評価(スコア付け)の手順
・レビュー本文と表の作成方針
それぞれの工程に必要な作業時間の見積もりも提示します。工程⑤:届出書類の作成
・安全性情報の根拠(JECFA、既存データベース等)
・分析方法や製造体制の説明
・パッケージ表現上の注意点
など、各種届出資料の概要と留意点を記載します。全体の作業時間見積と留意事項
各工程の担当人数・時間の内訳を表形式で提示。
進行状況や追加資料の有無により、所要時間が前後する可能性も明記しています。今後の進め方と選択肢
調査結果をご活用いただくための選択肢をご提示します。
・社内での届出作業への活用
・当社への継続的なご依頼
いずれのご判断にもご対応できるよう構成されています。
✅事前調査報告書の位置づけ
本資料は、届出作業の進行管理やリスク管理にお役立ていただけるとともに、
「社内で進めるか」「外部に依頼するか」のご判断材料としてもご活用いただけます。
事前調査のみのご依頼も可能です
調査結果は、貴社が独自で届出作業を進められる際にも、以下のような形でご活用いただけます:
全体の所要時間の見通しが立てやすくなり、スケジュールやリソースの計画に役立ちます
注意すべきポイントが明確になることで、作業の効率化・リスク回避につながります
ご不明点やご相談などがございましたら、どうぞお気軽にお問い合わせください。
今後のスムーズな申請準備の一助となるよう、丁寧にサポートさせていただきます。
機能性の根拠の書類作成 03〜08は研究レビューまたは臨床試験に分岐します
機能性表示食品の届出における「機能性の根拠」は、
研究レビュー(システマティックレビュー) または 臨床試験(ヒト試験) のいずれかを選択して作成する必要があります。

研究レビュー(SR、システマティックレビュー)とは
機能性表示食品における研究レビューとは
機能性表示食品の届出において、「研究レビュー(システマティックレビュー、SR)」とは、 機能性関与成分やそれを含む最終製品に対して行われた臨床試験の論文を体系的に検索・評価し、 その信頼性をスコア化しながら、総合的な考察を加えることで科学的根拠を示す手法です。
採用する論文は、自社による試験に限らず、他社・他機関の論文も対象とすることが可能です。 そのため、自社で新たに臨床試験を行わなくても、既存の論文をもとに届出を進めることができます。
呼び方としては「研究レビュー」「システマティックレビュー(systematic review)」「SR」などが使われますが、 いずれも同じ意味を持ち、消費者庁が定める機能性表示食品制度の中で、機能性の科学的根拠として正式に使用可能です。
なお、研究レビューという手法は食品分野に限らず、たとえば医療分野でも幅広く使われています。 医学分野では、薬の有効性や副作用、適正な使用量などを複数の臨床研究から総合的に判断するための方法として活用されており、 食品分野においてもその応用が認められています。
この研究レビュー(SR、システマティックレビュー)は、 消費者庁の定める機能性表示食品の制度において「機能性の根拠」として正式に使用できる手法の一つです。
機能性の根拠として使用できる方法は以下の2つがあります:
- 研究レビュー(SR):機能性関与成分または最終製品に関する既存の臨床試験論文を複数収集・評価し、考察を加える方法。
- 査読付き臨床試験論文:最終製品を対象としたヒト臨床試験を実施し、その結果を査読付きの学術論文として投稿・掲載する方法。
どちらの手法も制度上は認められておりますが、研究レビューは比較的短期間・低コストでの届出が可能な方法として、現在最も多く採用されています。
当社では、この研究レビューをPRISMA声明2020ガイドラインに準拠して作成しており、 制度上の要件を満たすだけでなく、第三者にも納得いただける信頼性の高い書類を提供いたします。
研究レビューの構成要素と流れ
研究レビューは以下の手順で作成されます:
- 計画書作成
検索式や採点基準などをまとめた計画書を弊社が作成し、仲裁役とも確認します。 - 文献検索
国内:医中誌、JDreamⅢ/海外:PubMedなど
検索式とヒット件数を記録し、未報告の研究(UMIN等)も確認します。 - 一次スクリーニング(要旨確認)
題名・要旨をもとに採用候補文献を選定。件数や日付を記録します。 - 二次スクリーニング(本文確認)
全文を読解し、研究レビューに採用する文献と除外文献を確定。除外理由も明記します。 - スコア化
各試験の妥当性を評価し、数値化(スコア化)。
研究員2名が独立して実施し、差があれば仲裁役が判断。 - 本文作成と考察
計画背景、検索方法、結果、採用文献の内容、スコア化の詳細、考察を記載。
そのうえで届出資料に使用する機能性表示文言を検討・記載します。
当社の研究レビュー作成体制について
当社では、3名の専門研究員による体制で研究レビューを作成しております。 評価の客観性と信頼性を高めるため、以下のような役割分担を明確にし、スコア化と考察を行っています。
■ 作成体制
- 論文の読解とスコア化は、研究員Aおよび研究員Bが独立して評価を実施。
- 両者の評価に差異がある場合は、研究員Cが仲裁と最終判断を行う方式を採用。
■ 研究員の構成(内訳)
- 研究員A:食品・化粧品の臨床試験に20年以上従事する医学博士(臨床試験受託機関に在籍)
- 研究員B:同じく15年以上の臨床試験経験を有する正看護師(臨床試験受託機関に在籍)
- 研究員C:国立大学法人に勤務する臨床医学系の教授(医師・医学博士)
このように、医師・看護師・研究者それぞれの専門的な視点を活かし、 多角的かつ公平な観点から研究レビューを作成しています。
研究レビューの作成を行う人数については2名以上が実行、1名以上が仲裁役を担当します。
この事は、消費者庁ホームページ(外部リンク)の『機能性表示食品の届出等に関するガイドライン内、別紙3 システマティックレビューの実施に係る考え方(例)』に以下の通り定義されています。
SRの客観性を保つために、レビューワーは原則として2名以上とする。
関連研究のスクリーニングは2名(A、B)以上が独立して行い、それぞれの結果に相違点や疑問点があれば両者の間で協議することとする。
協議の結果、それらの解決が困難な場合は、別のもう1名(C)以上が仲裁する。レビューワーA、Bには関連分野の学術論文(英語及び日本語)を批判的に吟味できるスキルが求められる。
また、レビューワーCについては、このようなスキルに加えて、博士又は修士の学位を有すること、査読付き学術論文の筆頭著者としての執筆経験を有すること、SRに精通していることなどを満たす者であることが望まれる。
上記のようなスキルを持つ者が身近にいない場合は、SRの一部又は全部の作業について、専門家への協力依頼等を行うことも可能である。
機能性表示食品の届出に於ける研究レビューの位置づけ
この研究レビュー(SR、システマティックレビュー)ですが、消費者庁の機能性表示食品の制度に於いて、機能性の根拠として用いる事が可能です。
この機能性の根拠ですが『機能性関与成分または最終製品による研究レビュー』の他には『最終製品を用いた臨床試験結果の査読付き投稿論文』も選択可能です。
弊社では機能性表示食品の届出にかかる工程を以下の通り01〜15の順に分けてご説明しております。
ここからご説明します研究レビューは以下の赤い枠線で囲んである03〜08に該当します。

研究レビュー作成の費用
当社では、研究レビュー(SR)の作成代行を税別120〜350万円前後で承っております。 作成期間はおおよそ2〜4週間で、PRISMA声明2020に準拠した高品質な内容にて納品いたします。
なお、採用する文献の有無を確認するための**事前調査(簡易検索や確認を含む)**が必要な場合は、 税別80〜100万円、期間は1〜2週間程度となる場合がございます。何卒ご理解ください。
研究レビューの所要期間は、機能性関与成分および届出文言の組み合わせにより、読解すべき論文数や作成作業の量が異なります。 そのため、正式なスケジュール・工数については個別にご相談を承っております。

研究レビュー作成の流れ

所要期間:2〜4週間
機能性関与成分と届出する文言の組み合わせによって、読解する論文数と研究レビュー作成時間が変化します。
03.計画書作成
当社では、事前調査報告書の内容をもとに、研究レビュー(SR、システマティックレビュー)の計画書を作成し、 仲裁役である研究員Cと共に確認作業を実施いたします。
この計画書には、論文の検索戦略や検索キーワード、採用論文に記載されたデータのスコア付け・採点基準などを明記します。 以下は、当社が実際に使用している計画書の一例です(作成者によって方法や内容は異なる場合があります)。
■ 検索対象の設定
- ヒトを対象とした臨床試験に限定。
- ランダム化並行群間比較試験およびクロスオーバー試験を対象。
- 言語は日本語または英語。
- 原則として原著論文とし、内容の特定が可能な短報・報告も可。学会発表抄録(会議録)は除外。
- 査読の有無は問わない。
- 出版バイアス回避のため、臨床試験登録データベースに掲載された研究も含む。
- グレー文献(博士論文、統計白書など)も内容が特定できる場合は採用。
- 比較対照群は、無介入または機能性関与成分を含まないものとする。濃度依存試験における低用量群を対照とすることは不可。
■ リサーチクエスチョンの例
- 「●●●の恒常的な摂取は、対照群と比較して●●●(●●●、●●●)を●●●させるか?」
■ 検索データベースと検索式の例
- 使用データベース:
- JDreamⅢ(JSTPlus、JST7580、JMEDPlus)
- 医中誌
- PubMed
- 検索式例:
- ○○○ AND (●● OR ■■■ OR ▲▲▲)
- (●● OR ■■■ OR ▲▲▲) AND ○○○
これらの計画を事前に文書化・共有し、研究レビュー作成の透明性と再現性を担保いたします。
スコア付ルール
スコア付のルールは以下の通り規定する。
■バイアスリスク
①選択バイアス
・ランダム化:ランダム割付けが適切に行われたかどうかを評価する。コンピューターによる乱数表を用いた場合、ランダム割付けの方法に起因する選択バイアスのリスクは「低」、出生日、個人 ID、試験登録日の奇数・偶数の別等により割付けを行った場合は「高」、論文において関連の記載が不十分だった場合は「不明」と評価する。
・割り付けの隠蔵:割付けの前に、割付けの隠蔵が適切に行われたかどうかを評価する。中央登録(介入実施者が割付けに関与せず、第三者的機関において集中的に登録を行い、その機関から割付けコードがもたらされる。)等により、臨床試験の参加者と実施者の両方が割付けを予測できなかった場合、割付けの隠蔵の方法に起因する選択バイアスのリスクは「低」、完全に隠蔵されていないと思われる方法による場合は「高」、論文において関連の記載が不十分だった場合は「不明」と評価する。
②盲検性バイアス
・参加者:臨床試験の参加者(介入群及び対照群)に対し適正に試験が行われるよう、臨床試験の参加者と関係者(実施者を含む。)に対し、割付けられた介入について適切に伏せられていたか(盲検化されていたか)どうかを評価する。両者への盲検化が確保されていた場合や、不十分な盲検化であってもアウトカムへの影響が低いと判断される場合、盲検化の方法に起因する実行バイアスのリスクは「低」、アウトカムへの影響が懸念される場合は「高」、論文において関連の記載が不十分だった場合は「不明」と評価する。
③盲検性バイアス
・アウトカム評価者:アウトカム評価が適正になされるよう、割付けられた介入について、アウトカム評価者への盲検化が行われたかどうかを評価する。盲検化が確保されていた場合や、不十分な盲検化であってもアウトカム評価への影響が低いと判断される場合、盲検化の方法に起因する検出バイアスのリスクは「低」、アウトカム評価への影響が懸念される場合は「高」、論文において関連の記載が不十分だった場合は「不明」と評価する。
④症例減少バイアス
・ITT、FAS、PPS:比較する群の間に、例数の減少等に起因した系統的な差がないかどうかを評価する。アウトカムデータの欠損数及び理由が介入群・対照群で同様と判断される場合、例数減少バイアスのリスクは「低」、アウトカムデータの欠損数及び理由が介入群・対照群で不均衡な場合や、割付けられた介入からかなりの離脱が生じた試験で、元の割付けではなく、実際に行われた介入を基に解析を行った場合(Per Protocol Set解析)は「高」、論文において関連の記載が不十分だった場合は「不明」と評価する。
・不完全アウトカムデータ:参加者全ての完全なデータを用いる事が出来ない事が発生している場合、不完全アウトカムデータ有りとみなす。理由としては、研究期間中の被験者の脱落や測定・分析の失敗等によりデータが欠損してしまう事などが挙げられる。不完全アウトカムデータについては、アウトカムデータへの影響が低いと判断される場合は「低」、影響がある場合は「高」とし、記載が不十分で判断が出来ない場合は「不明」と評価する。
⑤選択的アウトカム報告:選択的なアウトカムの報告によるバイアスがないかどうかを評価する。研究計画書や研究計画の事前登録に記載された主要及び副次アウトカムについて、研究計画どおりの方法で全て解析・報告されている場合、報告バイアスのリスクは「低」、あらかじめ指定されていた主要アウトカムの全てが報告されていない場合や、あらかじめ指定されていない測定方法、解析方法(当初の計画にはなかったサブ解析や中間解析等)などを用いて報告されている場合は「高」、論文において関連の記載が不十分だった場合は「不明」と評価する。
⑥その他のバイアス:上記以外のバイアスがないかどうかを評価する。他のバイアス要因がないと思われる場合、上記以外のバイアスのリスクは「低」、研究デザインに関連する潜在的なバイアスがあると思われる場合、不正が疑われている場合、その他何らかの問題がある場合は「高」、論文において関連の記載が不十分だった場合は「不明」と評価する。
・まとめ:各項目を合算し、−16〜−10点を高バイアス、−9〜−5点を中バイアス、−4〜0点を低バイアスとし、別紙様式(V)-11aに記載する。別紙様式(V)-13aへは“高(−2)”,“中(−1)”,“低(0)”の3 段階に換算してエビデンス総体に反映させる。なお、高バイアスとなった研究はエビデンスの総括に深刻な影響を及ぼす可能性があるため当該論文を分析から除外する。
■非直接性
研究レビューの PI(E)COSに対する各論文の非直接性(リサーチクエスチョンと各論文との間の各種条件の違い(対象者、介入、比較、アウトカム指標等の違い))についても評価する。
対象:採用論文の内容と本研究レビューの「P(Participants):参加者」との関係が直接的である場合は「低」、直接性が無い場合は「高」とした。
介入:採用論文の内容と本研究レビューの「I(Interventions):介入」との関係が直接的である場合は「低」、直接性が無い場合は「高」とした。
対象:採用論文の内容と本研究レビューの「C(Comparators):比較対照群」との関係が直接的である場合は「低」、直接性が無い場合は「高」とした。
アウトカム:採用論文の内容と本研究レビューの「O(Outcomes) :評価項目」との関係が直接的である場合は「低」、直接性が無い場合は「高」とした。
まとめ:各項目を合算し、−8〜−5点を高バイアス、−4〜−3点を中バイアス、−2〜0点を低バイアスとし、別紙様式(V)-11aに記載する、別紙様式(V)-13aへは“高(−2)”、“中(−1)”、“低(0)”の3 段階に換算してエビデンス総体に反映させる。
■不精確(サンプルサイズが小さい又はイベント数が少ない等により、効果推定量の信頼区間が広くなっていないかなど)
評価方法は例数(又はイベント数)と主要アウトカムを基に、メタアナリシスの有無にかかわらず、次のように定義する。その際、95%信頼区間が著しく広い研究も「高」と評価する。例数が合計 100 例以上は「低」 、41〜99 例は「中」、40 例未満は「高」とする。
■非一貫性(結果のバラつき)
メタアナリシスを実施した場合、次の項目のうち検定の実施条件に合致するものは確認を行う。「1.点推定値が研究間で異なり、その相違がかなり大きい」「2.各信頼区間の重なりが,ほとんどまたは全くない」「3.異質性検定(根底にある効果の大きさが全ての研究で同じであるとする帰無仮説を検証する検定)において,p<0.05 で帰無仮説を棄却できる」「4.I^2 値(研究間の差異による点推定値のばらつきの割合を示す)が大きい」。これらに1つ該当する場合は「中/疑い」、2以上該当する場合は「高」とする。
メタアナリシスを実施しない場合、各採用文献内の有意差検定を実施した項目かつ『本研究レビューのPI(E)COS』に該当する項目における「有意な効果が有った」「有意な効果が無かった」の割合を判断基準とした。報告数が1報のみの場合は「不明」とする。広告数が2報以上の場合、有効性有りの割合が0〜35%を「高」、36〜70%を「中/疑い」、71〜100%を「低」とする。
■その他(出版バイアスなど)
出版バイアスとは未出版の研究の存在により、正しく有効性が確認できない問題を指す。出版バイアスはFunnel Plot(Funnel plotの対称性はEgger検定で確認し、P<0.1を有意とする)を行い、対称性が確認されれば「低」、対称性が確認されなければ「高」、評価が不能な場合は「不明」とする。並びにUMIN-CTRの検索にて未報告試験の有無を調査し、上述の対称性を充足できると判断した場合は「低」とする。その他、評価を計画した内容以外のバイアスの存在が否定できない場合は、その評価方法について研究員C(仲裁役)による判断を得る事とする。
04.文献検索
研究レビューの作成にあたり、国内外の臨床試験(ヒト試験、食品試験)に関する文献・論文を網羅的に検索します。
- 国内の文献・論文:JDreamⅢ、医中誌Web 等を活用
- 海外の文献・論文:PubMed 等を使用
- 臨床研究の実施状況を把握する必要がある場合:UMIN 等を活用(詳細は「倫理審査」の項目内「UMINについて」をご参照ください)
検索対象には、日本語および英語で記載された論文を含みます。 日本語および英語以外の言語で記載された文献を使用する場合は、研究レビュー本文に日本語訳を添付いたします。
有効性関与成分と届出文言の組み合わせによって、読解すべき論文数や作業量が変動するため、 事前調査で予備的な文献検索を実施し、作業時間の見通しを立てた上でお見積りをご提示いたします。
05.文献要旨確認
検索した文献・論文は題名や必要に応じて要旨とかアブストラクトと呼ばれる論文の要約部分(数百文字)を確認しながら選別を行い、研究レビューの根拠論文として採用する可能性がある文献名・掲載誌・号数・ページ番号を抽出します。
これを一次スクリーニング(一次選別)と呼びます。
この抽出作業で用いた検索式(検索窓に入れた文言)と検索結果(ヒットした件数)の数字は、検索した日付と共に研究レビュー内に記載します。
この時点で未報告研究(実施中の臨床研究)の有無もUMIN等で確認しておきます。
未報告研究(実施中の臨床研究)とは、倫理委員会で試験実施承認(許可)を受けた臨床試験の計画は存在するものの論文になっていない情報を指します。
全ての未報告研究を把握する事は困難な場合もありますが、臨床試験の計画を登録するデータベースが有りますので、そちらを確認します。
06.文献本文読解
1つ前の工程(05.文献要旨確認)で、研究レビューの根拠論文として採用する可能性があると判断した文献を入手し、題名や要旨・アブストラクト以外の全文(本文・全体)の内容を確認します。
これを二次スクリーニング(二次選別)と呼びます。
この二次スクリーニング(二次選別)にて不要と判断した文献名は、不要と判断した理由と共に研究レビュー内に記載します。
07.スコア化
根拠論文として採用した論文の試験デザイン(投与量、投与期間、被験者数、被験者背景)および測定項目の結果の数値を表に書き出します。
次に、それら情報の科学的根拠・妥当性の観点でスコア化(採点・数値化)し、それら内容の総合スコア判定も行います。
2名の研究員が独立してこの作業を行い、スコア化に差異が生じた場合は仲裁役担当の研究員に判断を仰ぎます。
08.本文作成
そして研究レビューの本文として、計画を立てた背景、検索方法、検索結果、除外した論文の名称と理由、論文化されていないが実施が確認出来た臨床研究、採用した根拠論文の名称と研究方法・結果、スコア化した結果と理由を記載します。
これらの内容を基に、考察を作成します。
そして作成した考察内容を基に、機能性表示食品の届出資料に記載する表示したい機能性の文言を検討して記載します。
以上が研究レビュー作成の流れでございます。
臨床試験を新規で行う届出は少ない事および説明の内容が多岐にわたるため、本ページの下部に記載いたしました。
届出書類作成の流れ

所要期間:1〜2週間
届出書類の作成について
この工程では、消費者庁への届出に必要な書類の作成を行います。
研究レビューの完成と届出書類の完成が同時期となるように、作業開始時期を調整し、全体のスケジュール短縮を図ります。
必要書類には、安全性の根拠や製造・品質管理情報、健康被害情報の収集体制などが含まれます。これらはすべて、機能性表示食品の届出において欠かせない要素となります。
09.安全性
「安全性の根拠」は、機能性表示食品の届出において最も重要な5要件の一つです。
食経験・ヒト試験・動物試験・既存文献のいずれか、または複数を組み合わせて、安全性を体系的に示す必要があります。
ただし、一定の条件下で注意喚起を行うことで届出が認められるケースもあります。
例:「医薬品との併用に注意が必要です」などの注意書きをパッケージに記載することが条件になる場合があります。
弊社では、安全性に問題が見つかった時点で速やかに対策を検討するという方針で、届出準備を進めております。
そのため弊社では、安全性に問題が見つかった時点で速やかに対策を検討するという方針で進めています。
安全性の根拠に関する確認項目
食経験の有無(商品または類似物質の摂取実績)
例:摂取されてきた年数、消費量、出荷量など
ヒトによる安全性試験の有無
動物による安全性試験の有無
安全性情報の収集と探索の進め方
安全性に関する情報は、公的データベースや査読付き文献を活用して収集します。
代表的な情報源として、JECFA(FAO/WHO)、EFSA(欧州食品安全機関)、NIH/ODS(米国国立衛生研究所)、および厚生労働省「食品安全情報」サイト等が挙げられます。
必要に応じて学術論文の引用も行います。
弊社では、まずメーカー様からお預かりした資料を拝見し、既存情報のみで安全性の根拠として十分かどうかを確認します。
情報が不足している場合には、国内外の公的データベースや文献を探索し、追加の根拠を収集します。
万一、該当する情報が見つからない場合は、動物試験やヒト試験の実施をご提案いたします。
食経験の判定方法について
以下のような情報が「食経験あり」と判断されるうえで有効です:
日本国内での長期的な摂取実績(例:10年以上にわたり流通・摂取)
出荷量や販売量の記録(自治体・業界団体などの資料)
- 過去の食品用途・形態・摂取方法が、現在の商品と類似していること
これらの要件を満たす場合、「食経験あり」として安全性の根拠に活用可能です。
活用できる公的データベースの例
以下のような信頼性の高い公的機関のデータベースを活用しています:
JECFA(FAO/WHO 食品添加物合同専門家会議)
食品添加物・農薬・汚染物質の評価情報などを収録EFSA(欧州食品安全機関)
食品成分・サプリメントに関するリスク評価・報告書NIH・ODS(米国国立衛生研究所/栄養補助食品室)
サプリメント・ビタミン・ミネラル等の科学的評価厚生労働省「食品安全情報」サイト
国内の食品添加物・農薬・健康食品に関する通知・評価情報
これらは無料で閲覧可能かつ引用可能な情報源として、届出書類の作成にも役立ちます。
安全性の根拠について
機能性表示食品の届出において、安全性の根拠は非常に重要な要素です。
日本などでの長期間の食経験がある場合は、その情報のみで安全性の根拠として認められることも多くあります。
具体的には、**自社商品の摂取実績(類似商品でも可)や、他社製品・原材料に関する公知の情報(論文、業界紙、データベース等)**を用いて、安全性資料を作成します。
例:
- 日本国内で50年前から毎年数百トン消費されている
- 類似商品を10年前から販売しており、累計100万食の販売実績がある
一方で、食経験が短い成分や製品の場合は、動物試験やその他の安全性試験の結果に基づいたデータが必要です。
この場合も、自社で取得したデータのほか、公知の文献・データベース等を引用して資料を作成します。
例:
- マウスに3ヶ月間投与して血液・内臓に異常が見られなかった
- 菌を用いた変異原性試験においても異常なし(遺伝子への影響が見られなかった)
主な安全性試験の種類
以下は、届出時に参考とされることのある代表的な安全性試験の一例です:
■ 単回投与毒性試験(急性毒性試験/急毒)
マウスやラットに1回だけ大量に摂取させ、短期間での影響を観察します。
ヒトの体重換算で「これ以上は食べないであろう」という量を、チューブと注射器で投与し、安全性を確認します。
■ 反復投与毒性試験(慢性毒性試験/慢毒)
1〜9ヶ月間、毎日一定量を摂取させ、長期的な影響を観察します。
「自由摂餌(じゆうせつじ)」という方法でエサに混ぜて与え、毎日どれくらい摂取したかを測定することもあります。
■ 有効性確認試験(機能性確認試験)
高血圧や高脂血症、糖尿病などの症状が出やすいモデル動物(特定の遺伝的背景を持つマウスやラット)に対して、機能性関与成分を与え、症状の緩和効果を確認します。
■ 遺伝毒性試験
ニワトリの赤血球や菌を使って、関与成分が遺伝子に与える影響を調べます。
たとえば、菌の培地に成分を加え、繁殖に影響がないかを確認します。
なお、**擬陽性(ぎようせい)**と呼ばれる、誤った陽性結果が出ることもあるため、複数の試験方法で結果を総合的に判断することが望まれます。
過剰摂取に関する安全性の考え方
機能性表示食品では、通常摂取量と過剰摂取時の双方の安全性を評価することが求められます。
消費者庁では、食品形態ごとに以下の過剰摂取基準を定めています。
サプリメント形状の加工食品:通常摂取量の5倍
その他の加工食品/生鮮食品:通常摂取量の3倍
これは、消費者が意図せず多量に摂取してしまう可能性があるためです。安全性の評価は、食品の形態に応じて異なる基準で行います。
食品形態ごとの分類と安全性確認の目安
機能性表示食品は、以下の3つの形態に分類されます:
サプリメント形状の加工食品(例:カプセル、錠剤、粉末など)
その他の加工食品(例:飲料、菓子、惣菜、冷凍食品など)
生鮮食品(例:野菜、果物、魚介類など)
それぞれの食品形態において、過剰摂取に関する安全性の確認基準は次のとおりです:
① サプリメント形状の加工食品
→ 通常の摂取量の「5倍」を摂取した場合でも、安全性に問題がないことを確認します。② その他の加工食品・③ 生鮮食品
→ 通常の摂取量の「3倍」での摂取において、安全性が確保されているかを確認します。
なぜ基準が異なるのか
「①サプリメント形状の加工食品」は、摂取量の調整が比較的容易である一方、誤って多く摂取されるリスクが高いと考えられています。そのため、安全性評価はより厳格に行う必要があります(5倍量での確認)。
一方で、「②その他の加工食品」や「③生鮮食品」は、一度に大量摂取される可能性が比較的低いため、3倍量での安全性確認が基準とされています。
過剰摂取情報の重要性
過剰摂取時の安全性に関する情報は、届出審査時に消費者庁が特に重視する項目の一つです。機能性関与成分の特性と食品形態に応じた適切な基準に基づき、必要なデータや文献、試験結果を整理・記載することが、届出の円滑な受理につながります。
10.品質管理
機能性表示食品の届出では、製造工程・品質管理体制の明確化が求められます。
これは、製品が安全かつ安定した品質で生産されていることを示すためで、消費者庁への届出書類の中でも重要な項目です。
この工程の目的は、製品の品質が適切に管理されていることを明確に示すことです。
品質管理に関する提出資料の例
製造施設の所在地・認証(GMP、ISO 等)
成分分析機関と実施頻度
成績書(非公開)と分析手順書(公開版・黒塗り版)
生産に関する情報(非公開)
生産面では、商品の企画書や規格書などを作成・提出します。
これらの書類は非公開資料として扱われ、消費者庁のWebサイトには掲載されません。
製造に関する情報(公開)
製造については、以下のような情報を公開資料として届出ます:
生産工場の所在地
GMP(適正製造規範)やISO(国際標準化機構)の認証取得状況
これにより、製品が信頼性の高い施設で製造されていることを客観的に示します。
品質管理に関する情報
品質管理の項目では、機能性関与成分の定性・定量に関する資料を整備し、以下の情報を提出します:
分析機関名と、分析(定性・定量)の実施頻度(公開資料)
分析結果(成績書)(非公開資料)
分析方法の手順書(公開。ただし企業機密に関わる部分は黒塗りが可能)
分析方法に関する手順書は、
一部を黒塗りした「公開用PDF」
完全な内容を記載した「非公開用PDF」
の2種類を用意し、透明性と企業秘密の両立を図ります。
製造・品質確認に関する記載内容について
機能性表示食品の届出では、製品の製造工程が安全に管理されていること、
そして機能性関与成分がパッケージ表示どおりに含まれていることを示す必要があります。
食品の種類により、記載すべき内容は異なります。
加工食品・サプリメントの場合
以下の情報を記載します:
安全な製造設備で製造されていること
機能性成分の含有量が表示どおりであることをどのように確認しているか
例文
「ISOまたはGMP等の認証工場にて製造し、機能性関与成分が表示量どおり含有されていることを、原材料ごとに分析機関で定期確認しています。」
分析頻度や分析方法を定量的に明記(例:「ロットごと」「月1回」など)すると審査対応性が高まります。
生鮮食品の場合(野菜・果物・魚介類など)
以下の情報を記載します:
どの地域の農場・漁場で、どのような方法で栽培・収穫・水揚げされたか
機能性成分の含有量がどのように確認されているか
どこで包装・出荷されているか
例文
「○○県○○市の管理された農場で栽培され、機能性成分が表示どおり含まれていることを週1回確認。○○県○○市の施設で包装後、出荷しています。」
このように、製造工程や品質管理体制の信頼性を示すことで、製品の安全性と機能性が確保されていることを届出書類にて明示することが求められます。
11.情報収集
健康被害の情報収集体制について
届出時には、健康被害(有害事象)発生時の情報収集・対応体制の整備も必要です。
提出資料には、以下の3点を明示します:
① 消費者からの問い合わせ窓口情報
② 社内報告のフローチャート(部署・責任者を含む)
③ 記録・報告書の保存方法と期間
公開・非公開の取り扱いについて
「お客様相談室・窓口の連絡先」
→ 消費者庁のWebページにて公開されます。「組織図」および「有害事象対応フローチャート」
→ 届出時に提出は必要ですが、非公開扱いとなり、消費者庁ホームページでは公開されません。
この体制の整備は、製品の安全性を確保し、消費者からの信頼を得るために非常に重要です。
また、これらの資料は届出書類の一部として整備し、適切に保存しておくことが推奨されます。
お客様相談室に関する情報の届出について
届出では、商品パッケージに記載されるお客様相談室の情報に加え、
社内での情報伝達や対応体制も整理し、消費者庁へ提出する必要があります。
具体的には、以下を届出書類として提出します:
商品パッケージに記載されるお客様相談室の連絡先(電話番号・受付時間など)
お客様相談室に寄せられた内容を社内でどのように伝達・協議・対応するかの体制
(例:社内フローチャートや対応部門への連携手順など)
これらのうち、連絡先などの基本情報は消費者庁のWebページで公開されますが、
社内対応体制の詳細(フローチャートや組織図など)は非公開情報として取り扱われます。
この体制の整備により、万が一の健康被害に迅速かつ適切に対応できることを示し、
消費者の安心感と信頼性の向上に寄与します。
12.作用機序
**作用機序(Mechanism of Action)**とは、機能性関与成分がヒト体内でどのように作用し、表示される機能性(例:血圧維持、脂質代謝改善など)をもたらすのかを説明する科学的記述です。
2025年4月以降、研究レビューの最終ページに作用機序の記載が義務化されました。
情報の引用元について
作用機序の説明は、主に研究レビューで採用する臨床試験論文から引用します。
ただし、ヒト試験で明確な説明がない場合は、動物試験や細胞試験の論文も参考文献として利用することがあります。
作成時の注意点
作用機序の記述は、研究レビューで導き出された機能性の根拠となるため、
表示する機能性文言(ヘルスクレーム)との整合性を十分に確認しながら作成する必要があります。
たとえば、「血圧を維持する機能」を表示する場合は、
血管拡張作用や利尿作用など、関連性の高いメカニズムが論理的に説明されていることが求められます。
13.表示内容
パッケージ表示文言の作成と届出用データの準備
機能性表示食品のパッケージに記載する機能性表示文言や必要な表記内容は、弊社にて文章を作成し、テキスト形式などのデジタルファイルでご提供いたします。
その後、御社のデザイン担当者様にて実際のパッケージデザインへ文言を組み込んでいただきます。
完成したパッケージデザインはPDF形式で保存し、届出用資料としてご提出いただきます。
パッケージの表示文言は、「食品表示基準(平成27年消食表第139号)」等に準拠する必要があります。
誇大表現・医薬的効能を連想させる表現は禁止されており、弊社ではヘルスクレームの適正化をサポートいたします。。
パッケージデザインの届出と変更について
機能性表示食品では、商品パッケージのデザインも届出書類の一部として消費者庁へ提出します。
そのため、届出後のパッケージデザインやキャッチフレーズの変更には注意が必要です。
変更内容によっては、消費者庁が受理していない(想定外の)表現となり、制度の趣旨から外れる可能性があります。
■ 届出後のデザイン変更について
パッケージデザインを変更する場合は、**消費者庁への「変更届出」または「軽微変更届出」**が必要です。
軽微な修正であれば、一般的に2〜5週間で受理されます。
届出の流れ

所要期間:20〜48週間(5〜12ヶ月)
この期間(約5〜12ヶ月)は、届出書類の提出後、消費者庁による確認・修正対応を含みます。
届出後60営業日前後で受理・差し戻しの通知がメールで届くため、社内スケジュールに余裕をもたせることが推奨されます。
14.届出
届出用ID・パスワードの発行
御社に対して、消費者庁の届出専用システムにアクセスするためのIDとパスワードを発行します。
発行手続きはWeb上で完結し、通常即日発行が可能です。消費者庁専用データベースへの書類アップロード
発行されたID・パスワードを用いて、消費者庁の専用データベースにアクセスし、
届出に必要な書類をアップロードします。
届出手続きが完了すると、翌営業日の朝6時頃に、消費者庁から以下の内容の仮受付メールが届きます。
■メール件名例
【機能性表示食品制度】届出情報の仮受付について
■メール本文(一部抜粋)
機能性表示食品制度の届出情報を仮受付いたしました。
※受付はまだ完了していません。
このメールは、あくまで「届出情報を仮受付した」ことを通知するものであり、
正式な受付完了ではありません。
この後、消費者庁が届出内容の確認を行い、必要に応じて**修正依頼(差し戻し)**が送られてくる場合があります。
正式な受理までの詳しい流れについては、次の項目でご案内いたします。
届出作業をサポートする「詳細な手順書」をご用意しております
弊社では、届出専用ポータルサイトでの操作マニュアルを無償提供しております。
ID発行、様式データの作成、PDF化、アップロード手順など、初めての方でも迷わず操作できる内容です。
届出作業には、以下のような操作が含まれます:
Webフォームに文章を一つずつコピー&ペーストで入力する作業
書類をPDF形式に変換してアップロードする作業
それぞれの操作について、
事前にどの書類をPDF化しておくと効率的か、
ファイルの命名規則やサイズの注意点など、
作業をスムーズに進めるためのポイントを手順書内に丁寧にまとめています。
初めて届出を担当される方でも安心して取り組めるよう、
実際の画面イメージも交えたわかりやすい内容となっております。
もし操作中にご不明点があれば、Zoomなどでのオンラインサポートも承っておりますので、
お気軽にご相談ください。
画像:手順書のイメージ
弊社では、以下のようなファイルを用いてお客様と作業を円滑に進めて参ります。
例:加工食品(エキス不使用)の場合の場合のファイル
届出時には消費者庁のWebフォームに、様式は内容をコピー&ペースト、別紙様式はPDF化してアップロードします。
■様式1 届出食品基本情報
1①様式1 届出食品基本情報.docx
1②別紙様式(1).xlsx
■様式2 安全性に係る事項
2①②様式2 安全性に係る事項.docx
2②別紙様式(2).docx
■様式3 生産・製造及び品質管理に係る事項
3①様式3 生産・製造及び品質管理に係る事項.docx
3②−1別紙様式(3)-1-1.docx
3②−2別紙様式(3)-1-2.docx
3②−3別紙様式(3)-2.docx
3③−1別紙様式(3)-3.docx
3③−2別紙様式(3)-4.docx
3④分析方法(公開用、マスキング可).docx
3⑤製品規格書、分析成績書(非公開).docx
■様式4 健康被害の情報収集に係る事項
4①様式4 健康被害の情報収集に係る事項.docx
4②組織図及び連絡フロー(非公開).pptx
■様式5 機能性に係る事項
5①様式5 機能性に係る事項.docx
5②別紙様式(5)-1-1.docx
5③別紙様式(5)-1-2.docx
5④別紙様式(5)-3.docx
5⑤別紙様式(5)-4.docx
5⑥別紙様式(5)–5〜17
5⑦別紙様式(5)-1-18.docx
■様式6 表示に係る事項
6①様式6 表示に係る事項.docx
6②表示見本.pptx
■様式7 自己点検等報告
7①様式7 自己点検等報告.docx
7②別紙様式(7).xlsx
■その他
8①(参考)届出に係る資料一覧.xlsx
8②ファイル一覧、届出に向けた準備について(打合せスライド).pptx
8③届出用のユーザーID発行方法について.pptx
8④消費者庁へのWebでのアップロード手順.pdf
届出成功のためのチェックリスト(要約)
機能性関与成分の科学的根拠は十分か
食経験や安全性データを裏付ける文献が揃っているか
製造・品質管理体制の証明資料を整備しているか
パッケージ文言は法令準拠か
届出スケジュールは社内調整済みか
これらを事前に確認することで、差し戻しリスクを大幅に減らせます。
15.修正対応
届出が完了すると、翌営業日の朝6時ごろに消費者庁から「仮受付メール」が届きます(詳細は前項参照)。
その後、約60営業日ほどで、消費者庁より「受理」または「差し戻し(修正が必要)」に関する通知メールが届きます。
■ 受理された場合
件名:
【機能性表示食品制度】届出の受付完了について
本文抜粋:
機能性表示食品制度における届出の受付が完了いたしました。
受付番号:
商品名:
届出日:
届出番号:
■ 差し戻しされた場合
件名:
【機能性表示食品制度】届出の不備について
本文抜粋:
届出内容に不備がありましたので、IDを使って「機能性表示食品制度届出データベース」にログインし、差し戻し理由・コメントをご確認のうえ、届出内容を修正してください
差し戻し後の対応
差し戻し通知を受けた場合は、コメント内容に沿って修正を行い、再提出します。
消費者庁による再確認・受理までの期間を短縮するためにも、コメントの意図を正確に理解し、的確に修正することが重要です。
弊社からの対応期日のご案内
消費者庁から差し戻し通知が予想される時期の直前に、弊社より御社宛てに「そろそろ消費者庁から連絡がある頃です」という対応期日のご案内を差し上げています。
これにより、スムーズな修正作業と再提出の準備が可能となります。
。
発売予定日の設定について
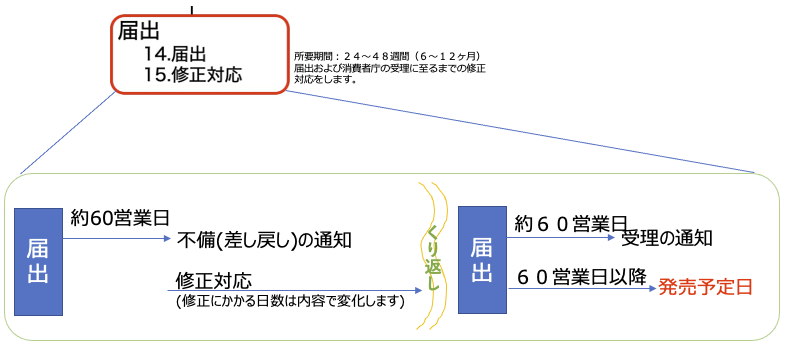 発売予定日の設定について
発売予定日の設定について機能性表示食品のWeb届出時には、発売予定日を設定する必要があります。
この発売予定日は、届出日から60日以上先でなければなりません。
新規の機能性関与成分の場合は、60日ではなく120営業日が必要です
■ 通常の流れとスケジュール感
届出後、おおよそ60営業日以内に消費者庁から「受理」または「差し戻し(不備)」の通知が届きます。
そのため、設定する発売予定日が受理通知日とほぼ同時期になることがあります。
■ 製造開始のタイミングにご注意ください
届出にはパッケージデザイン(表示見本)の提出が必須です。
デザインに不備があれば差し戻しとなり、受理前の製造開始はリスクが伴いますのでご注意ください。
■ 届出番号の表記について
受理後には「届出番号」が付与され、パッケージへの記載が必須です。
パッケージ印刷が間に合わない場合は、届出番号を記載したシールを後貼りする対応も可能です。
発売スケジュールと届出手続きは販売計画に大きく影響します。
最適なタイミングでの届出と製造が行えるよう、弊社でもサポートいたします。ご不明点はお気軽にご相談ください。
届出から約60日営業日後に消費者庁から受理・差し戻しの通知(メール)が来ます
受理された場合
機能性表示食品の届出が正式に「受理」されると、消費者庁より以下のような受理通知メールが届きます。
件名
【機能性表示食品制度】届出の受付完了について本文(一部抜粋)
機能性表示食品制度における届出の受付が完了いたしました。
受付番号:
商品名:
届出日:
届出番号:
このメールは朝6時頃に届き、その日の夕方までに消費者庁の検索ページに反映されます。
届出番号の取り扱いについて
メールに記載されている**「届出番号」**は、商品のパッケージに必ず記載しなければなりません。
このメールの到着をもって、「正式に発売準備を進めてよい段階」となります。
なお、届出番号の印刷が発売に間に合わない場合は、後からシールを貼付する対応も可能です。
スケジュールや製造計画に合わせて、適切なタイミングを検討してください。
届出が受理されてからの流れ
発売開始
受理通知メールの届出番号を確認のうえ、商品の販売を開始します。
パッケージには届出番号の記載が必要です(シール対応も可能)。Web届出画面で「発売中」に設定
販売開始後、消費者庁のWeb届出システムにログインし、販売ステータスを『発売中』に設定します。
これにより届出情報の公開ページにも「発売中」と表示されます。将来的な研究データの更新・制度変更への対応
発売後も以下のような場合に、研究レビューや届出書類の修正が必要になることがあります。
- 新たな臨床研究論文の発表による機能性関与成分の知見の更新
- 消費者庁の制度改正や事後チェック(点検)による届出書類の修正
これらの変化に迅速に対応できるよう、発売後も継続的に情報を収集し、体制を整えておくことが重要です。
機能性表示食品の届出時の注意点まとめ
A. 健康の維持と増進が目的
予防や治療を目的とした臨床試験結果は使用不可。
機能性表示食品制度では「維持」としての記載が求められる。
医薬品的な効能表現は食品には使用できない(日本の制度上)。
B. 臨床試験の被験者は「健常人」
医薬品のような強い作用は期待できず、健常者で効果が出にくい場合もある。
境界域や軽症者での評価が認められるケースもある(例:血圧、血糖値、認知機能)。
C. 年齢層・性差による有効性の違いの考察
年齢や性別による効果の違いが明確な場合は、パッケージに対象者の限定を記載する。
例:中高年向けの記憶力維持、中高年女性向けの骨の健康維持など。
D. 一般化された評価方法の使用
独自評価法は妥当性証明が困難。
学会ガイドライン、公的機関基準、広く引用される論文の方法が望ましい。
E. 人種や生活様式による違いの考察
日本人の体格・栄養状態・気候・代謝と大きな差がないことが条件。
F. パッケージ・広告で適切に機能性や対象者を伝える
要点のみを強調しすぎると誤認を招く恐れがあるため注意。
G. 医薬的効能効果への接近・暗示は避ける
商品名やキャッチコピーで誤認を招く表現にならないよう配慮。
H. 作用機序の記載は適切に
科学的根拠をもとにした説明が必要。
2020年4月以降の事後チェック制度で審査は厳格化。
I. SR(研究レビュー)かRCT(臨床試験)かの明示
SRは伝聞形式(例:「○○が報告されています」)。
RCTは断定形式(例:「○○に役立ちます」)。
J. 表示文言の表現(断定 or 補佐)
測定指標が直接的か間接的かを踏まえ、表現を明確に区別する。
K. 届出した機能性のみ表示可能
複数の機能性を記載する場合は、それぞれに対応する研究レビューが必要。
届出していない効果効能は表示禁止。
薬機法により、がんやリウマチなどの記載は禁止。
L. 原材料メーカーからの許諾取得について
一部メーカーは「原材料+研究レビュー使用許諾」を提供。
他社の研究レビューの流用は著作権問題があり推奨されない。
転記・加工による回避はリスク・手間が大きく、結果的に自作が安全かつ管理しやすい。
機能性表示の評価指標
膝関節の柔軟性・可動性
KOOS(Knee injury and Osteoarthritis Outcome Score)
JOA(日本整形外科学会のアンケート)
※学会認定の評価アンケートを使用。
記憶力の維持(加齢による低下への対応)
学会基準のアンケートや筆記テスト
近赤外線トポグラフィーによる脳血流測定
目の健康
コントラスト識別テスト
黄斑色素量の光測定
ルテインなどの血中濃度測定
お腹の脂肪の減少
内臓脂肪面積のX線CT画像評価(撮影条件統一)
体重の減少
体重計測、体脂肪率、血中脂質データ
中性脂肪の上昇抑制
食後中性脂肪の経時的採血(30、60、90分)
空腹時中性脂肪の開始前と1〜3ヶ月後の比較
血糖値の上昇抑制
食後血糖値の経時的採血
空腹時血糖値の長期経時変化評価
整腸効果
排便回数・性状・便量(自己申告)
腸内細菌の菌数と種類(便検体解析)
コレステロール
HDL(善玉コレステロール):高値が望ましい
LDL(悪玉コレステロール):低値が望ましい
※採血による評価
リラックス効果
自律神経バランス(心電図などから算出)
ストレスホルモン(IgA、コルチゾール):唾液・血液測定
肌の保湿
表皮の水分量(通電法による測定)
水分蒸散量(温湿度計で計測)
睡眠改善
脳波(アルファ波、ベータ波などの変化を電極で測定)
睡眠アンケート(主観評価)
疲労改善
POMS(Profile of Mood States)などのアンケート
血中乳酸値などの疲労関連物質測定
脂肪代謝の促進
呼気中CO₂量の変化による評価
血圧
安静時血圧の測定(環境条件を統一)
眼や鼻の不快感
アレルギー指標に基づく血液データ
免疫関連
血液指標+対応するアンケートの組み合わせで評価
サポートの種類について
補佐と代行はいつでも切り替え可能
御社の作業内容やご希望の負担割合に応じて、弊社は以下の2つのサービス形態でサポートいたします。
① 補佐(支援・コンサルティング)
御社で届出書類を作成される場合の支援です。
必要な部分だけ弊社の専門知識や人材を活用可能。
費用を抑えつつ、御社主体で作業を進められます。
② 代行(受託)
御社にて届出書類の作成時間が取れない場合の全面代行サービス。
最低限、届出ID発行やお客様相談室周辺の組織図作成など一部作業は御社にてご対応いただきます。
御社の負担を大幅に軽減します。
料金について
補佐・代行いずれも 時間単価は同じ です。
作業時間が同じならば、費用総額に違いはありません。
初めは補佐で始めて、途中から代行に切り替えることも可能です。
ただし、研究レビューは作業の連続性が必要 なため、計画書完成後の切り替えは一部作業の重複が発生する場合があります。
費用の計算方法
作業時間×時間単価
外注費用(文献取り寄せ費など)
国(消費者庁)への支払いはありません。
作業開始前に、作業時間予定表や完成予定日を提示し、計画的に進行します。
定期的に作業時間と外注費用を報告し、適正かつ品質を保った費用算出を行います。
多くのお客様から継続的なご依頼をいただいております。
ご不明点や切り替え希望など、いつでもお気軽にお申し付けください。
補佐と代行いずれもお任せください
機能食品研究所では、研究レビュー(SR、システマティックレビュー)作成の補佐(支援、コンサルティング)と代行を行っております。
いつでもお気軽にお問い合わせください。
補佐と代行の違いについて
研究レビュー(SR、システマティックレビュー)の作成は臨床試験の実施経験者による作成補佐(支援、コンサルティング)と代行を行なっております。
機能性表示食品の研究レビュー作成ですが、2名以上の研究者(研究者A,B)と1名以上の仲裁役(研究者C)にて行う規定が有ります。
■補佐(支援、コンサルティング)をさせて戴く場合、弊社スタッフ1名が仲裁役(研究者C)を担当します。
■代行(受託)として全てお任せいただく場合、弊社スタッフから2名(研究者A、研究者B)と三重大学の医師・教員から1名(仲裁役(研究者C))の計3名が担当します。
なお補佐(支援、コンサルティング)と代行(受託)のいずれも時間あたりの単価は同じでございます。そのため、作業にかかる時間が同じであれば合計金額は変わりません。
但し、研究レビューの性質として、同一の研究者が一貫して作業を実施する必要が有ります。そのため計画書完成前の切り替えは容易ですが、計画書完成後の切り替えは作業が一部重複する事をご容赦願います。
事前調査のみも承っております
研究レビュー作成の作業を進める上で必要な『作業時間数』や『注意点』を検討する事前調査のみも承っております。
事前調査については、こちらをご覧ください。
事前調査を行うメリットは以下の通りです。
①御社様のみで研究レビュー作成を取り組まれる場合
→何時間ぐらいかかるかの計画が立てやすくなります。
→どのような部分にお気をつけいただくべきか明確になります。
②弊社に補佐や代行をご依頼される場合
→具体的な費用と期間をご提示出来ます。
食品、サプリメント、化粧品、ヘルスケア用品の臨床試験(ヒト試験、食品試験、皮膚試験、RCT)を実施
弊社は食品、サプリメント、生鮮食品、化粧品、ヘルスケア用品(ボディーソープ、洗顔料等)の食品臨床試験(ヒト試験)、化粧品臨床研究(肌試験、皮膚試験)の受託を2004年から行っている食品CROです。
【高い専門性】
三重大学医学部の教員・医師との連携により再現性の高い臨床研究を行います。
弊社の臨床試験受託会社としての20年以上(2004年〜)の経験をもとに、迅速丁寧に進めて参ります。
【消費者庁への届出まで総合サポート】
機能性表示食品の届出のために必要な臨床試験計画書の作成から、臨床試験実施、論文投稿、機能性表示食品の届出資料作成、届出・消費者庁とのやり取りまで総合的にサポートいたします。

写真:臨床試験の現場風景(三密を避け、定期的な換気を行っております)
これらの臨床試験のうち、食品、サプリメント、生鮮食品の臨床研究(ヒト試験、食品試験)は、機能性表示食品の届出にもご使用いただけます。
機能性表示食品とは消費者庁の制度の1つです。
弊社では試験計画書作成 ・ 倫理委員会申請 ・ 試験準備 ・ 試験実施 ・報告書作成 ・学会発表 ・ 論文投稿 ・ 機能性表示食品の届出・ 広告用資料作成補佐など全ての工程を受託しております。
臨床試験の実施は三重大学 医学部 , 附属病院 , みえ治験医療ネットの医薬品治験の経験を持つ医師・研究者が臨床試験の要所を担当する事により、再現性の高い臨床試験(ヒト試験、RCT)の実施が可能です。
報告書は三重大学の教員・医師による考察入りです。
また、2018年に施行された特定臨床研究法に基づく臨床試験が必要な場合についても三重大学にて審査と実施が可能です。(リンク:厚労省ホームページ 臨床研究法について)
機能性表示食品の制度における臨床試験の利点
機能性表示食品の、機能性の根拠として『研究レビュー(SR・システマティックレビュー)』と『臨床試験の実施』が有ります。
表示出来る機能性について、研究レビューでは少し遠回しな文言になるところ、臨床試験ではストレートな説得力の高い表現に出来る利点があります。
機能性表示食品に於ける食品臨床試験の位置付けは以下の赤い枠線内の通りです。
以下の部分では、以下の工程図の赤い枠線内『臨床試験(右側の03〜08)は』についてご説明いたします。

測定項目
受託可能な臨床試験の測定項目
血圧降下作用(血圧)
脂質系減少作用(空腹時・脂質負荷TG、各種コレステロール、X線CT)
血糖値降下作用(空腹時・糖負荷時血糖値、HbA1c)
皮膚の保湿性・バリア機能等(皮膚伝導度、経表皮水分蒸散量、粘弾性)
皮膚の皮脂減少作用(通常時皮脂、洗浄後の回復皮脂)
皮膚のきめ・角質の傷み(表皮の表層・深層の拡大写真を皮膚科専門医が判定)
運動後の疲労回復作用(血中乳酸値、血糖値、抗酸化、心拍数、筋力)
眼精疲労軽減作用(フリッカ値、5m視力、VAS、自覚アンケート)
リラックス効果確認(唾液IgA、唾液コルチゾール、唾液アミラーゼ、脳波)
唾液分泌量増加作用(唾液分泌速度・量)


皮膚科測定機器
■①肌の保湿(角層水分量)(Skicon200EX)
皮膚表面のコンダクタンス(伝導度)を測定することで保湿性を評価します。
水分を含んでいればいるほど電気が流れる量が増えます。微弱な電流なので、ピリッとした痛みなどは一切ありません。

■②バリア機能(経表皮水分蒸散量)(Tewameter TM300)
皮膚から蒸散・蒸発する水分量を測定し、バリア機能(角層の傷み)を評価します。
バリア機能が損なわれると皮膚から水分が蒸発し、水が逃げる(蒸発する)量が増えます。

■③肌の張り(粘弾性)(Cutometer MPA580)
吸引装置と圧センサーにより、皮膚の硬さや弾力性・伸展性を見ます。
筒状のセンサーを肌に押し当て、ポンプで吸い上げます。吸い上げた時に皮膚が伸びるスピード・長さや、開放した時の戻るスピード・長さを使って自動計算します。
肌年齢の評価や、光老化の程度評価にも用いられます。

■④肌表面の油分(油分量)(Sebumeter SM815)
皮膚表面の油分を測定します。
弊社では2種類使っております。どちらも原理は同じでして、皮脂を吸着するテープを皮膚に貼り付け、テープに付いた皮脂の「量・にじみ具合」を機械で数値化・目視判定します。平常時の皮脂量だけでなく、洗浄後30分間で皮膚表面に出てくる皮脂を計測する事も出来ます。


■⑤写真判定(角質の傷み(いたみ),肌理(きめ),くすみなど(Dermlite ProⅡ・ i scope)
撮影した皮膚表面の拡大画像を皮膚科専門医が各項目を4~7段階評価にて判定します。
たとえば角質の傷み(いたみ)を例にしますと、以下の通りの5段階基準に沿って判定を実施。
0:なし(落屑(らくせつ)無し)
1:軽微(点状の落屑)
2:軽度(鱗状の落屑)
3:中等度(膜状の落屑)
4:重度(全体に落屑)
たとえば被験物質のクリームを使う前は「4:重度」だったのが、使用4週後に「2:軽度」になったと評価したり、数値データからプラセボ(対照)との差を確認する事もできます。


■⑥シミ・シワ・ニキビなど(皮膚画像自動解析システム)(Visia Evolution)
シミ、かくれジミ、毛穴、メラニン、ポルフィリンなどを画像解析により評価します。
同一の照明条件と3次元ポジションマッチング機能により高い位置再現性を持っています。
■⑦皮膚科専門医による問診
皮膚科専門医という皮膚科医としての診療・研究歴の有る医師が問診を行います。
■⑧皮膚科専門医による問診時の視診判定(乾燥・紅斑など)
皮膚科専門医の認定を受けた医師が目視で4~7段階にて評価いたします。その時に写真を撮影し、デジタル写真をご提供することも出来ます。

■⑨被験者さんご自身のアンケート・VAS(使い心地など)
アンケートやVAS(ビジュアルアナログスケール)にて被験者さんご自身の感じられた使い心地・感想などを数値化いたします。
■⑩内科問診・血液検査(安全性確認)
経皮吸収の可能性がある場合または経口摂取の被験物質の場合、内科問診・血液検査を行い安全性の確認をされる事をお勧めいたします。
■⑪pH(酸性・中性・アルカリ性度合い)
肌を計測出来るよう平坦な形になったガラスプローブを肌に押し当て計測します。酸性・中性・アルカリ性の度合いが数値で出てきます。

臨床試験の流れ
ここからは、機能性表示食品の届出を目的とした臨床試験を例にご説明いたします。

所要期間:48〜72週間(12〜18ヶ月)
機能性関与成分と届出する文言の組み合わせによって、被験者数、測定回数等が変わって参ります。
特定保健用食品として許可が出ている表示文言(ヘルスクレーム)の測定項目の場合は、それら商品の臨床試験論文と同じ条件で実施する事になります。
それ以外の測定項目の場合は科学的根拠を満たす範囲で条件を設定します。
機能性表示食品の届出を目的とする場合、論文投稿は査読(さどく)付きである事が必須となります。査読とは、その論文の科学的妥当性があるかどうかを査読員・レフリーにより審査をする事を指します。
03.計画書作成
03-1.仕様書(計画骨子・計画デザイン)を作成
最初の工程として仕様書(臨床試験の計画骨子・計画デザイン)を作ります。
(前の工程「02.事前準備」で作成した場合はスキップいたします)
仕様書はA4サイズ4枚で構成しております。
そこには測定項目の種類や組み合わせ、摂取(サプリメント等の場合)・塗布期間(化粧品等の場合)や被験者数の情報を記載します。
そしてその仕様書を基に統括医や評価専門家を交えた打合せを行います。
その打合せにはお客様にご同席いただく事により、お客様のご要望を多く盛り込んだ計画書に仕上がります。ご足労をおかけして恐縮ですが、何卒よろしくお願い申し上げます。
計画書より前に仕様書を作成する理由
弊社の仕様書はA4サイズ4枚で構成された試験計画書の骨子を指しております。
A4サイズ4枚ですと、社内で回覧して赤ペン修正を入れていただく事が簡単なため、お客様と統括医・専門家の先生のご意向を何度も伺いやすい利点があります。
いきなり20枚前後の文章だらけの試験計画書の形でやりとりすると変更点・加筆点が分かりづらいので、この方法を採用しております。
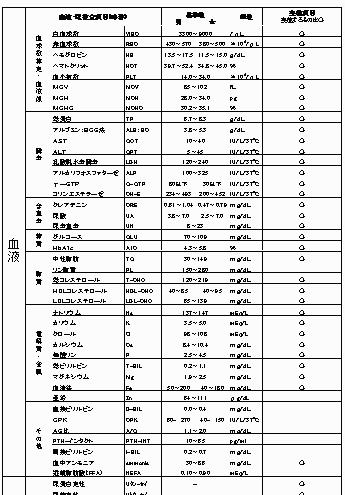
仕様書の構成は、『1枚目に試験デザイン』『2枚目に血液分析項目・皮膚測定項目と測定条件』『3枚目に日誌で取得するアンケート内容』『4枚目に現場で取得するアンケート内容』です。
もちろん4〜5枚程度にまとめた仕様書を作らず、いきなり30枚以上の試験計画書を用いて打ち合わせを重ねる事も可能です。
しかし、枚数が多い書類で何度も何度も変更履歴・朱書き・打ち消し線を使ってお客様・先生・弊社で打合せをするのは関係者全員の負担が多くなります。
そのため、ご多忙なお客様・先生の労力を少しでも減らす事ができればという気持ちで1~4枚の紙だけで全体が把握出来る仕様書(試験デザイン)で内容を練り上げる方法を採用しております。
練り上げが必要なのは理由が有ります。
たとえば同じ測定機械であっても試験の目的などによって設定・測定回数・条件を検討する必要が有ります。それに測定の日程や測定する部位も目的と照らし合わせて設定する必要が有ります。
そのため、これらの項目を何度も練り上げて
「もう、目を閉じていてもイメージ出来る。」
「もう、これ以上は変更無さそうだ!」
となってから、試験計画書に流し込むと円滑に進みます。
その結果、以下のようなお客様からご感想をいただきました。
「1~4枚の表だけで話が出来るのは魅力。
別の仕事で頭が一杯でも、瞬時に頭を切り換えて対応できるよ。」
「1~4枚の表だと、社内で企画・広報・営業など様々な部署の方々に
『こういう試験をするけど測定しておきたい項目や、使用感アンケートの設問の追加は有りませんか?』
という質問の回覧をする速度が上がり快適。」
「今までのあらすじを、サッと把握し直せるので、見落としの心配が無いね。
頼み忘れが無いかしらという心配もしなくて良い。」
■1枚目に試験デザイン
【題名】
何を確認する試験かという内容を短文で表します。
例:○○抽出物による食後血糖値上昇抑制試験。
【二重盲検法(ダブルブラインド)などの種別】
被験者(モニター)さん・統括医・弊社スタッフなど試験現場に関わる全員が、どの被験者さんが何を摂取・塗布しているかを知っている・知らないかなどの種別。
現場の全員が知らない場合を二重盲検法(ダブルブラインドテスト)と言い、先入観・恣意・思惑が入らない試験が出来るため、弊社は原則としてこの方法を使用しています。
【群の構成・内訳】
被験物質とプラセボ(コントロール)を何名ずつで実施とか、どの被験者(モニター)さんも被験物質とプラセボ(コントロール)を各々別々の期間に両方とも摂取・塗布するなど。
例:25名×2群
【摂取・塗布期間】
何分・何時間・何日間どのように摂取・塗布するかなど。
例:最初の1週間は前観察として全員がプラセボ(コントロール)を摂取し、次に4週間は各群に割り振られた物質を摂取。
【主な測定項目】
最も結果を期待している項目を1つ書きます。
これが主解析項目となります。
例:LDLコレステロール
【その他の測定項目】
主解析項目の次に結果を期待している項目を数個書きます。
これが副次解析項目となります。
例:HDLコレステロール、体脂肪率、中性脂肪、体重
【測定スケジュール】
何週目で何を測定するなど、表にします。
【概算】
実施時期・被験者数別などに分けた額です。
例:8月開始●●●万円、9月開始●●●万円
【目的】
主な測定項目・その他の測定項目と重複しますが、この試験の目的を文章化します。例:●●抽出物8週間摂取によるLDLコレステロールおよびその他脂質系への効果を探索する。
【被験者背景】
年齢幅・性別・血液や肌状態の条件など。
例:20~45歳、男女、乾燥肌(機器測定値●●μS未満)
【有効性判定方法】
どの項目が、どのような数値になったら有効性有り、それに届かずともこの数値になったら傾向有りと判定するなど。
例:0週目に対する変化量の群間差で有意差が●.●▲未満であれば有効性有り、●.■●未満であれば傾向有り。
【安全性判定方法】
安全性の判定方法です。例:全被験者の各データをカルテ化して統括医が判定し、必要に応じて●●検定にかける。
【統計解析の方法】
統計解析の方法です。例:群間は●●検定をし、多重比較補正は●●を使用。
【御契約から報告書提出までのスケジュール】
御契約から報告書完成までの流れです。
例:10月上旬 御契約・統括医を交えたスタートアップミーティング、11月上旬 計画書案完成、11月中旬 倫理委員会書類提出、11月下旬 試験のシミュレーション実施・計画書の完成・倫理委員会への修正報告、12月 倫理委員会承認・被験者募集開始、1月下旬 摂取開始、3月下旬 摂取終了・速報提出、4月下旬 報告書案提出・御社を交えた打合せ・報告書完成。
【参考文献名】
どんな文献を参考としたかを明確にします。
例:●●使用による食後中性脂肪上昇抑制 XXXX vol.62 320-329 2010

イメージのため画質は荒くしてあります。
■2枚目に血液分析項目・皮膚測定項目と測定条件
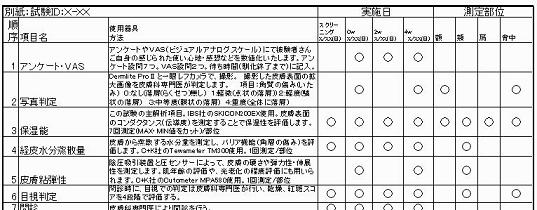
イメージのため画質は荒くしてあります。
■3枚目に日誌で取得するアンケート ■4枚目に現場で取得するアンケート内容
アンケートは毎日自宅で書いていただく日誌内のアンケートと、測定現場にてお書きいただくアンケートが有ります。
論文投稿先の選定
以下のように臨床試験結果を予めイメージし、そのイメージに沿って論文の投稿先についてご提案します。
以下のようなご提案を使用書作成段階で詰めておきますので、先の予定をイメージして戴きやすいです。
「効果が有ったとしたら、グラフがこんな感じになります。」
「主要評価項目(解析方法)で有効性の有意差が出なくとも、副次的評価項目で更に細かくこの項目・条件で有効性を探索します。」
「この評価項目でこんな数字が出たら、考察に●●が■■だったと書けます。」
「安全性のみが確認出来たら、このランクの雑誌に投稿。有効性も確認出来たら、このランクの雑誌投稿・学会発表しませんか?」
それらを可能としているのは、最新の治験・医学・臨床・生物統計の技術・経験・情報を有する三重大学 医学部 , 附属病院 , みえ治験医療ネット等の様々な機関・講座との密な連携が有るからです。
内科分野の研究デザインの作成方法
ここでは食品・ドリンク・サプリメントなどのように経口摂取(口から摂取)する試験の場合の組み合わせ方について頭に思い描いてください。
そこに以下のような項目を組み合わせていきます。
【 】の中にかかれている記号(☆★●▼■)は、後ほど説明いたします。
【☆(試験の)目的】【★(測定する)項目】
①空腹時の血糖値
②食事直後の血糖値の推移
③空腹時の中性脂肪
④食事直後の中性脂肪の推移
⑤各種コレステロール
⑥体脂肪率
⑦腹部断面画像の面積解析
⑧血圧
⑨リラックス・ストレス
⑩眼精疲労
⑪体温変化
⑫血流量変化
⑬唾液分泌速度
⑭内科問診・安全性確認用の血液検査
⑮被験者さんご自身のアンケート(使い心地など)
【●(摂取・使用・塗布する)期間】
1回、2回、2週間、4週間、8週間、12週間
【▼測定(する日)】
摂取開始3週前、摂取開始2週前、0週目(摂取前)、4週目、8週目、12週目、終了日から2週後、終了日から4週後
【■(被験者さんの)人数】
15名×2群、20名×2群、30名×2群
この5つを先ずはザックリと組み合わせておき、後ほど具体的な内容を詰める事になります。
以下、組み合わせ方の例を2つ作成いたしました。
例1:
【☆(試験の)目的】
サプリメント摂取で「①空腹時の血糖値」が下がる事の確認
【★(測定する)項目】
①空腹時の血糖値
⑭内科問診・安全性確認用の血液検査
【●(摂取・使用・塗布する)期間】
4週間
【▼測定(する日)】
摂取開始3週前、摂取0週目(摂取前)、摂取4週目
【■(被験者さんの)人数】
20名×2群(被験物質群とプラセボ群の計2群)
例2:
【☆(試験の)目的】
ドリンク摂取で「③空腹時の中性脂肪」が下がる事の確認
【★(測定する)項目】
③空腹時の中性脂肪
⑤各種コレステロール
⑭内科問診・安全性確認用の血液検査
【●(摂取・使用・塗布する)期間】
8週間
【▼測定(する日)】
摂取開始3週前、摂取0週目(摂取前)、摂取4週目、摂取8週目
【■(被験者さんの)人数】
25名×2群(被験物質群とプラセボ群の計2群)
この分野をご存じ無い方であっても、5つ(☆★●▼■)の内容を変えていけば良いと把握していただけると思います。
皮膚科分野の研究デザインの作成方法
では次に、化粧品石鹸・衣類・美容機器・ヘルスケア用品のように皮膚に使用する場合です。
ここでは【☆(試験の)目的】【★(測定する)項目】のみ増えます。
①肌の保湿(角層水分量)
②バリア機能(経表皮水分蒸散量)
③肌の張り(粘弾性)
④肌表面の油分(油分量)
⑤写真判定(角質の傷み(いたみ)、肌理(きめ)、くすみなど)
⑥シミ・シワ・ニキビなど(皮膚画像自動解析システム)
⑦皮膚科専門医による問診
⑧皮膚科専門医による問診時の視診判定(乾燥・紅斑など)
⑨被験者さんご自身のアンケート・VAS(使い心地など)
⑩内科問診・血液検査(安全性確認)
⑪pH(酸性・中性・アルカリ性度合い)
では例を作ってみます。
例3:
【☆(試験の)目的】
化粧品使用で「①肌の保湿(角層水分量)」が上がる確認
【★(測定する)項目】
①肌の保湿(角層水分量)
⑦皮膚科専門医による問診
【●(摂取・使用・塗布する)期間】
4週間
【▼測定(する日)】
塗布開始2週前、塗布0週目(塗布前)、塗布4週目
【■(被験者さんの)人数】
20名×1群 (同一人物の左右別々の腕に被験物質とプラセボを各々塗布し20名×2群と同じ量のデータを確保)
ここまでご説明しますと
「それでは、美容ドリンク・美肌サプリメントのように食べたり飲んだりする物質の肌試験も出来るよね?」
というご質問をいただく事が多いです。
はい、もちろん可能です。
例4:
【☆目的】
ドリンク摂取で「①肌の保湿(角層水分量)」が上がる確認
【★項目】
①肌の保湿(角層水分量)
⑩内科問診・血液検査(安全性確認)
【●期間】
8週間
【▼測定】
摂取開始3週前、摂取0週目(摂取前)、摂取4週目、摂取8週目
【■人数】
25名×2群
統括医・専門家の先生との打合せについて
試験計画書を作成する前に行います『仕様書』の作成におけるお客様と統括医・専門家の先生交えた打合せについてお話をさせていただきます。
弊社の臨床試験は、試験の内容が例えば内科分野であれば内科の先生、皮膚科分野は皮膚科の先生のように、その分野のご専門の先生に統括医師・統括・アドバイザーをご担当いただいております。
お客様と統括医・専門家の先生との打合せは、仕様書作りの最後の詰めの段階にて行います。
03-2.計画書を作成
前の工程で作成した仕様書に肉付けをしていき、臨床試験実施の計画書を作成します。
この時点で試験結果を推測し、「このような数値の増加であれば考察にこのように書けますね」という意識の擦り合わせも行います。
この計画書作成時に、以下のような内容を再確認いたします。
「有効性・効果が認められた時、グラフがこのような感じになります。」
「主要評価項目(解析方法)で有効性の有意差が出なくとも、副次的評価項目で更に細かくこの項目・条件で有効性を探索します。」
「この評価項目でこのような数字が出たら、考察に●●が■■だったと書けます。」
「有効性も確認出来たら、●●学会誌に投稿か▼▼学会で発表を予定。安全性のみが確認出来たら、■■雑誌に投稿ですね。」。
このように、結果の使用方法などのような試験後の事について、関係者全員の認識にズレが無い事を確認し、計画書の完成となります。
04.倫理審査
臨床試験の実施は事前に倫理委員会による許可を得る必要が有ります。
その審査では人道的な違反が無い事や適切な測定方法であるか等が審査されます。
倫理委員会へは『計画書』の他に『同意取得用の説明書(インフォームドコンセント)』や被験物質の『概要書(安全と分かる資料)』等を提出し、審査を受けます。
特定臨床研究による臨床試験が必要な場合についても三重大学にて審査・実施が可能です。
倫理委員会に提出する情報について
被験者さんに何かを渡し、それを飲んだり食べたり塗ったりしていただく試験、つまり『介入を伴う試験』は倫理委員会にて試験実施の許可を得る必要が有ります。
弊社の行う臨床試験は全て三重大学の先生に統括していただき実施している事から、三重大学医学部附属病院での審査を受けております。
その審査に必要な行程は全て弊社が全て行いますので、お客様(メーカー様)には【被験物質・対照物質についての情報】のみ弊社にご提供いただくだけでご負担がかかる事は有りません。
■審査を受ける項目
①試験の目的
②被験者(モニター)さんに参加をお願いせねばならない理由
③必要以上の採血量・測定回数で負担をかけていないか
④同意の取り方は妥当か・無理強いとか嘘は無いか
⑤摂取・塗布量は妥当か
⑥プライバシーを守る方法は妥当か
⑦不測の事態が起こった時の対応方法は妥当か
⑧データの不正・捏造の防止のためのモニタリング方法
⑨利益相反の有無
■書類の種類。
これは三重大学医学部附属病院の場合ですが、以下の書類を作成していきます。
・倫理委員会申請書
・試験計画書
・同意説明文書
・同意書
・被験物質概要書
・利益相反関連の申告書
これらの書類を作成し、統括医の先生を始め関わっていただく先生全員の押印をいただいてから倫理委員会事務局へ提出です。
そして審査日に審査会に出席し答弁を行い、委員の先生から戴いた是正事項を速やかに修正して承認を受けます。
■被験物質・対照物質について必要な情報
先述の「⑤摂取・塗布量は妥当か」について、以下のような情報が情報が必要になります。
成分などによってご準備いただく情報の数・種類は変化しますが、一番多い時は以下の情報となります。
A 有効性関与成分の作用機序
B 配合している物質の安全性情報(公的データベース等の情報も可)
・国内外での食経験 ・動物試験 ・遺伝毒性(新規性のある物質の場合)
C 被験物質・対照物質に配合されている物質の情報
D 既に臨床試験をされた場合は、その結果
E 既に販売されている場合は販売年数・販売数量
倫理委員会へ提出する種類の選定については、お客様と統括医師の先生を交えた打合せの時に
「この有効性関与成分は新規の発明かつ未発売ですよね。そのため遺伝毒性試験や動物試験の結果が無いと、ヒトに摂取していただいても大丈夫という判断は難しいかもしれませんね。」
などのように取捨選択をしていきます。
・・・とは言いましても、お客様のご準備の都合もございます。
臨床試験の実施自体の有無について検討をされる前に知っておきたい、というご相談も多くいただきます。その時は、お気軽に弊社までお問い合わせください。
「今までの経験上、これとこれは必要かと思われます。」というご説明をさせていただきます。
■審査にかかる期間
内容によって期間は前後しますが、通常の臨床試験の場合は2〜3ヶ月で承認を受けます。特定臨床研究の場合は3〜5ヶ月かかります。
審査の承認を受けるまでの間、メーカー様と試験統括医を交えた試験内容の最終調整や次の工程である被験者さん募集の準備を行います。
お客様の「1日も早く試験結果を見たい」というお気持ちに応えられるよう、常に進め方の無駄を省く工夫を生み出しております。
無駄を省きすぎたり急ぎすぎて試験内容の詰めの作業が疎かになるという本末転倒にならないよう慎重かつ迅速に行動いたします。
UMIN(ユーミン)またはjRCTへの登録について
■UMINについて
UMIN臨床試験登録システム(大学病院医療情報ネットワーク:University Hospital Medical Information Network Clinical Trials Registry)というインターネット上の登録サイトが有ります。
どのような試験が計画されているかとか実施されたか等という情報が集積されるシステムです。
機能性表示食品のガイドラインにUMIN等への事前登録が必要と記載されております。
臨床試験実施にあたり、登録は弊社にて全て行いますのでお客様のお手を煩わせる事はございません。
登録時に試験毎に登録番号が発行されまして、論文の投稿先によってはUMIN等の試験登録システムの登録番号が無いと受理しませんと投稿規定に書いてある事が増えて来ました。
よく「何の為に事前登録するんだろう?」と聞かれる事が有ります。
将来どこかで誰かが似たような被験物質で似たような方法で臨床試験をする時に
「あれ? この事前登録をされた計画は論文投稿や学会発表がされていない。 何か有害事象などの問題が発生したのだろうか?」
と、世の中に出ていない危険性に気付く事が出来たりするそうです。
(結果が悪かったデータが公表されにくい事を「出版バイアス」と呼びます)
しかし、事前登録をするとお客様のライバル会社が
「あの会社がこんな試験をやり始めるぞ。よし我々も真似して追いかけよう。」
と戦略が筒抜けになってしまうのが難点です。
そのため消費者庁の制度である機能性表示食品の場合は、消費者庁の機能性表示食品のルールでは登録から1年間は非公表の状態にしても良いというものがございます。しかし厚労省による被験者保護の観点では、非公表は推奨出来ないとの事です。
■jRCTについて
2018年春からの特定臨床研究というルールに沿った研究をする時はこのjRCT 臨床研究実施計画・研究概要公開システム(Japan Registry of Clinical Trials)に登録します。こちらもUMINのように「こういう研究を実施します」と掲載するWeb上のデータベースです。
UMINとの違いは、登録した時点で厚生労働省にて研究内容の確認・チェックが入る事が挙げられます。また、定期的な監査の報告書をアップロードする仕組みもあり、より再現性のある研究を行う事が出来ます。
動物試験の種類について
■1.経口摂取(飲んだり食べたり)する被験物質の場合
①単回投与毒性試験
マウスやラットに被験物質を1度だけ投与し、主に一般状態を観察します。
急性毒性試験とも言います。
②反復投与毒性試験
マウスやラットに被験物質を1~9ヶ月間毎日投与し、一般状態、体重変動、血液検査、 病理学的検査など多くの項目について被験物質の安全性を観察します。
③有効性(機能性)確認試験
高血圧、高脂血症、糖尿病などを発症させたマウスやラットに被験物質を投与し、 症状の緩和程度を確認観察します。
④遺伝毒性試験
微生物を用いる復帰突然変異試験(Ames[エイムス]試験)などの試験があります。 被験物質に遺伝子の突然変異誘発性の有無を確認します。
被験物質が遺伝子に悪影響を与えないかが分かります。
■2.塗布(肌に塗る)する被験物質の場合
⑤皮膚刺激性試験
毛を刈ったウサギ、モルモット、ミニブタなどの背中に被験物質を1日または14日間の塗布をし、 発赤や腫れ等の有無から刺激性を観察します。
⑥皮膚感作性試験
モルモットを用い、被験物質の皮膚での感作性の有無を確認する試験です。
(感作 : アレルギーなど抗原抗体反応)
これら①~⑥の他にも、様々な動物試験を用いて被験物質の性質に応じた安全性試験や機能性試験を行い、ヒトでの反応や影響を予測します。
被験物質とプラセボにかけていただく保険について
被験物質とプラセボを被験者様が摂取や塗布された時、何か健康被害が出た時の補償の手段として保険がございます。
一般的にメーカー様が既にご加入の保険でカバーされる事が多いのですが、いざ健康被害が発生してから『実は対象外だった』という事では大問題です。
と確認していただきますようお願いしております。
被験物質とプラセボにかけていただく保険については上述の通りですが、研究計画書の通りに実施した事による被害については倫理委員会を通じて国大協サービスの保険に加入しております。
05.試験の実施
05-1.被験者さんを募集
倫理委員会にて臨床試験実施の許可を得た後、試験の目的に合致する被験者さんを募集します。
被験者さんは弊社に被験者登録(モニター登録)していだいている方々宛のダイレクトメールや、新聞広告等で募集いたします。
■被験者さんへの呼びかけ
弊社に登録いただいている被験者さまに以下のようなご連絡をし、被験者背景・来院日程・摂取期間などの合致するかたにご参加いただいております。
こういう試験にご協力いただけませんか?
こういう条件のかたを募集しています。
こういう頻度で採血します。
こういう頻度で被験食品を摂取して貰います。
試験期間中は、こういう事に気を付けてください。
これらのような各項目が、的確に伝われば伝わるほどヒト試験の精度は上がります。
十人十色という言葉が有りますように、同じ説明資料をご覧いただいても感じ方や解釈は人それぞれと思います。
それだからこそ、皆様に的確にお伝えするためにイラスト・言葉遣い・レイアウト・配色を試行錯誤のうえ改良しながら、伝える技術を磨き続けております。


■募集から選出までの流れ
・募集要項と申込用紙の作成〜練り上げ
倫理委員会申請書(計画書など)の作成時、募集要項・申込用紙も作成します。臨床試験受託業を2004年から運営しておりますが、募集要項は常に進化し続けております。
当初は文字の羅列だったのですが、イラストを入れるようになったり、漫画にしてみたりと試行錯誤しております。今は漫画のコマ割りの1つ1つにテーマを決め、このコマは目的とするとか、次のコマは流れ図のように明確に分けております。今のところ、分かりやすいというお言葉をいただいておりますが、もっと何か他の方法が無いかと常に模索中です。
形になってきましたら統括医の先生・アドバイザーの先生にご覧戴きます。
先生からは『この試験はこういう意図でこういう被験者さんを集めるべきだから、申込書の設問にこういう内容を入れておくべき。』『この部分は重要だから、文字サイズをもう少し大きくするように。』というご指導をいただきます。
その部分を修正してから、倫理委員会申請書類と共に倫理委員会事務局に提出します。倫理委員会からのご指摘をいただいた場合は、そこを修正して完成となります。
・募集開始
弊社に登録してくださっているモニターさんへの連絡を行います。
弊社には研究に賛同してくださっている登録モニターさんがいらっしゃいます。
その方々へ募集要項・申込用紙をお送りしております。(弊社の他の臨床試験にご参加いただいる最中・ご参加直後の方は対象外となります。)
弊社の登録モニターさんだけでは募集人数に満たないと予想される時は新聞の広告掲載も行います。
新聞広告という限られた面積の中に、いかに皆様に興味を持っていただける内容を書けるかが勝負です。
新聞社のデザイナーさんと統括医の先生のご支援・ご指導のもと、広告原稿を創り上げます。そして広告掲載です。広告掲載日は多くの方からのお問い合わせやお申し込みが有りますので、少し早めに出社して待ち構えます。
新聞のような広域な募集方法の他に、生後間もない赤ちゃんが被験者さんの場合は病院、運動習慣の有る方の場合はスポーツジムのように対象となる方が集まりやすい場所にポスター掲示・申込用紙の設置をお願いする事もあります。
■集計作業(被験者さん選出)
募集開始直後から申込用紙がFAX、Webなどで届きます。お申し込みいただいた方の中から、『被験者さん選出用の測定・問診・採血の日』にお越しいただく方を選出する作業の開始です。
申込用紙の情報から氏名・住所・電話番号を分離し、代わりにID番号を付与した『集計表』を統括医の先生・アドバイザーの先生の所に持参し、選出に関するご指示をいただきます。
募集要項・申込用紙の作成時にご指示をいただいてはおりますが、実際に届いた申込用紙の内容の組み合わせは多岐に渡ります事から、実際の内容を先生にご覧いただき細かなご指示をいただくのです。
このようにして、被験者さん候補の方々に試験内容を分かりやすくご説明してご賛同を得てお申込いただいております。そして統括医の先生・アドバイザーの先生のご指導・ご指示をいただき、試験の目的に合致する方々を的確に選出しております。
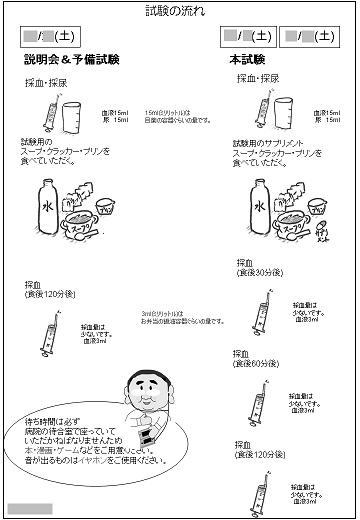
05-2.試験実施
試験品を被験者さんに摂取(外用剤の場合は塗布)していただきます。
被験者さんの募集を開始した頃、ご依頼主(メーカー様)には被験者さんに摂取(サプリメント等の場合)・塗布(化粧品等の場合)していただく為の『被験物質(商品など)』と『対照物質(被験物質から有効性・機能性成分を抜いたもの。プラセボとも言います。)』をご準備していただきます。
もちろんパッケージ・中身の色などは被験物質と対照物質に差が出ないよう統一していただきます。
臨床試験現場へは臨床試験の測定で使用する機器・手法の持ち込みも可能です。もちろんご依頼いただいた臨床試験について実施会場の見学も可能です。
正しい臨床試験運用のためNPO法人みえ治験医療ネット等による運用調査(モニタリングや監査)を受け、臨床試験の公平性を保つため試験実施中に有効性データの解析は行わない等の対策を行っております。
被験物質と対照物質のご準備について
倫理委員会への申請書を書き上げ、メーカー様と試験担当の先生のご確認をいただき大学病院に提出。次は被験者様募集の準備にかかるのですが、この頃からメーカー様には被験物質と対照物質のご準備計画を立てていただく事が多いです。
■容器
容器ですが、いずれの群も全く同じ容器でお願いします。容器自体には何も記載しないでいただきたいです。何か書かれていたりすると被験者様に「自分がどちらの群だろうか?」と勘ぐりされてしまう可能性が有るためです。
研究という性質上、対照物質の存在を被験者様もご承知の上でご参加ですが、少しのヒントを見かけると心の中に住まう探偵が「何だろう?」と思ってしまうものです。
もし何かしらの目印を付けられる時は、簡単に剥がせるシールでお願いします。
弊社側でシールを剥がし、被験者様のID番号に貼り替えるからです。A群・B群のようにアルファベットを振っていただくのですが。発音が似ているアルファベットの組み合わせはお避けください。B群・D群やM群・N群、L群・R群とか発音・聞き取りミスによる悲劇が発生してはなりません。
このように容器に何も記載されないようお願いしておりますが、製造年月日は記載しても良いですかというご質問をいただく事もあります出来ましたら、いずれの群も同日にしていただけるとありがたいです。
容器にシールを貼られない場合は容器を入れて宅配便で送っていただく時の段ボール箱の表面に「A」とか「B」のようにどちらの群かを記載いただきます。
念の為の確認ですが、決して「被験物質」「プラセボ」のように書かないでください。
弊社も関係者の先生もA群が何でB群が何かは知らない状態で試験を実施せねばならないからです。これを二重盲検(ダブルブラインド)と言い、恣意が入らない公平な試験方法です。
どちらがどの群かを知っていると、この方は血圧が低くなるはずなのに何故か高いな、再度測ってみよう・・・等という恣意が無かったと証明出来ません。
以下、ご説明のために話を創作します。
↓
『お客様が宅急便を発送された時の話。お客様から「さっき、宅配便を発送したんだけど段ボール箱にプラセボとデカデカと書いてしまった。どうしよう。」と連絡がありました。
宅配便の伝票番号によると未だお客様の近所の集配所周辺に有ったため、事情を説明してメーカー様にお戻ししていただきました。もし弊社に届いてしまっていたら、ご返送にかかる日数が余分にかかる所でした。』
いかがでしょうか?
この創作話が、現実に起きてしまわない事を願っております。
■ご提供いただく時期
ご提供いただく時期ですが、被験者様にお渡しする1週間ほど前に弊社に到着として戴いております。
万が一、先述のような理由でご返送して再送していただくという事が発生しても間に合うようにと設定すると1週間ほど前という事になります。
■数
数ですが多めにご準備いただきます。可能でしたら2倍以上ご準備いただき、余った分は御社様で保管しておいていただけますと幸いです。
理由の1つとして、被験者様側で事故が発生する事が有ります。愛犬が容器を倒して割ってしまった等、様々です。そういう時は弊社に保管してある予備を被験者様の自宅まで速やかにお届けします。そのため、少し多めに弊社に送っておいていただきます。
他の理由は、メーカー様から弊社に届く間等に発生する事故です。
再び、創作話を例とします。
↓
『宅配便業者さんから「ここ数日、快晴なのに何故か段ボールの底がビチャビチャです。底が抜けないよう気を付けてください。」と言って渡され、恐る恐る段ボールを開封すると中身の液体が漏れているものが多数。
急いでお客様に連絡しました所「大丈夫、こんな事もあろうかと3倍作ってあります。まずは代わりを急いで送る作業をしますので、ビチャビチャな方の返送方法は後ほど電話しますね。」とご回答いただき、事なきを得ました。』このように輸送中の事故で万が一の全滅が発生した時用に御社様にもう1回分ほどストックしておいていただけると非常に助かります。
御社様の測定機器の持ち込みについて
以下のような理由で、メーカー様から測定機器を持ち込んでいただく事も可能です。
「自社で保有している血液分析装置を試してみたいけど、採血後10分以内に前処置を完了させねばならない。」
「測定機器を自社開発したので、それを現場に持ち込みたい。」
「皮膚に粘着シールを貼って優しく剥がして角質を採取するとき、自社開発した分析方法に最適な力加減で採取したい。」
「最新の機器を買ったから、それも使って測定したい。」
その場合、メーカー様には「現場で指揮をしていただけませんか? 弊社スタッフがアシスタントをします。」とご提案しております。
もちろん、どの被験者さんが被験物質群・プラセボ群のいずれで有るかという情報は現場に居る弊社スタッフ・医師・看護師・測定にお越しくださったメーカー様の誰も分からないようになっておりますので「この被験者さんは対照群だから、この数値はおかしいな、もう一度測りなおそう。」という恣意は生じないのでご安心ください。
弊社の考えですが、「説明書を読んで習得します。」と「使った経験がある。」は、似ているようで違うと思っております。
例えば料理ですが、同一の包丁を使ったとしても初心者と熟練者の差が出るそうです。 そのため、熟練者の方が居らっしゃるのであれば「宜しければ、測定にお越しいただけませんか?」とご提案しております。
もちろん、メーカー様から「貴社で使い方を習得してください。」というご依頼をいただいた時は、入念に使用練習をし、更に写真入のマニュアルを自作する過程でイメージトレーニングも重ねます。
測定者の腕前による微細な誤差でも、採取したデータが多ければ誤差が積み重なって大きな差を生んでしまわないとは言い切れません。そのため使用法について細かいニュアンスまでメーカー様に確認をして入念に準備を重ねます。
試験会場の見学について
弊社は、臨床試験を発注してくださったメーカー様に、その発注していただき実施している試験現場の見学をしていただいております。
リラックス度合いを測定する試験のような被験者さんへの圧迫感を少しでも減らしたい試験や、被験物質を飲んで30分後、60分後、90分後、120分後の採血を行うような常に秒単位での精度が必要とされる測定し直しが出来ない試験は事情を説明したうえで見学をご遠慮いただき、現場の雰囲気が分かる写真をお送りしております。
見学をしていただく時、以下2点のみお気を付けいただきます。
1 被験者さんへの過度な緊張が有ってはならない。
2 試験実施の精度が落ちてはいけない。
■1 被験者さんへの過度な緊張が有ってはならない。
メーカー様には普段着でお越しいただいております。弊社の場合、ヒト試験実施会場では、白衣は医師と採血担当看護師のみ、スーツは現場責任者1名のみです。
他のスタッフは全員普段着なのです。 白衣やスーツのような堅い服装の人数は少しでも減らしておく事により、被験者さんに対する圧迫感が発生しないようにしております。
柔らかい表情と、堅くない服装により、日常と同じリラックスした状態で試験を行う事ができるようにしているのです。
■2 試験実施の精度が落ちてはいけない。
メーカーご担当者さまにとっても、被験物質(商品)への想いと情熱が山ほど詰まった大切な臨床試験です。 そのため見学の説明は現場責任者が丁寧に行いたいのです。 しかし、その日の最も重要な仕事は試験実施現場での精度を保つことです。
早い時間帯は各測定・採血工程が予定通り機能する事や、機器の動作が安定している事を先入観無しに落ち着いて入念に確認したいため、心に少し余裕が出てくる時間帯以降に来ていただきます。
公平性を保つ方法について
弊社はお客様窓口を一元化しております。
営業のご挨拶から、試験内容の打合せ、試験の実施、統計解析・グラフ化、報告書の納品まで全ての行程を一元化しておりますため、お客様から「窓口が1つなのが便利」と言われております。
どの行程もお客様のお考えと想いをしっかりと伺い、
「それならば、この測定項目とこの計算方法が最適です。」
「では、このデータも参考用にとっておきましょう。」
「この工夫をする事により精度を更に上げ、細かな有効性データも見逃さないようにします。」
と、トコトンまで何度も熱い気持ちで打合せを重ね、お客様の目的・目標を実現するお手伝いをしております。
いよいよ明日から試験本番(摂取・塗布・使用開始)がスタートですという時、窓口からお客様に1点必ず以下のご説明を申し上げます。
「速報提出時、つまりキーオープン(群の内訳開示)完了まで、試験の公平性を守るため、感情を入れないメール文章での連絡に切り替わります。お手数をおかけしますが、なるべくメールでの連絡でお願いします。」
これには理由が有ります。
試験実施中に電話でお客様と連絡を行った場合
「あれ?お客様窓口の声のトーンがいつもより明るい気がする。何か良い結果が出ている事を隠している?」
とか
「声のトーンが気のせいか低いな、外出先だから声を押し殺しているか、もしくは試験結果が良くなかったのを隠している?」
「この話口調だとポジティブな結果だったと思う。ネガティブな結果だったら、ここまでスラスラと喋らないだろうから・・・」
のようにお客様側で深読みが生じるかもしれません。
私を含め弊社のスタッフのうち一部の者は、試験の実施中に安全性に関わるデータには目を通しております。
その理由ですが、試験が終わってから血液データ等の結果を見たら、実は試験最中に有害事象が起きていた事が分かったなんて事が有ってはいけません。 (安全性の観点から常にデータを把握しておく責任が有ります。 )
原則として、有効性に関わるデータは把握しないようにしておりますので、試験中は知りません。 しかし、お客様からしましたら「試験中の時期でも実は知っているはず。」と思われて当たり前です。
私が逆の立場でも、そう思います。
その結果、口頭は失言のリスクが有るので、何度も推敲できるメール連絡にすれば良いという結論に至りました。 試験前はあんなに色々と熱く打合せを重ねていたのに試験が始まったら静かになるのは、このような理由があります。
06.データ解析
06-1.速報作成
臨床試験の全ての測定を完了させましてから約14日(お急ぎの場合は短縮可)で、速報データとして主解析項目の結果のグラフを提出します。
弊社は通常、試験の最終日(最終測定日)から、データ量にもよりますが約14日で、有効性に関する速報データ・グラフをお出ししております。お急ぎの場合は10日以内も可能です。
お出しした内容をご覧いただいたお客様から
「早いね。」
「この期間で、これほどの情報が出てくるとは驚き。」
と言っていただけている事から、ご満足いただけていると実感しております。
お客様は1日も早くデータをご覧になられたいという気持ちです。
そのお気持ちに応えるためにも、速報データを迅速に作成するための効率的なシステムを3つ作りました。
①ほぼ自動の作表システム
②統計解析とグラフの自動作成
③オリジナルのチェック表
これら3つを簡単に説明いたします。
【①ほぼ自動の作表システム】は、測定現場にて測定機器からパソコンに自動記録されたデータをそのまま使って作表できるスグレモノです。 パソコンに繋がっていない機器や自動記録非対応の機器の場合も、少ない作業で作表できるようになっております。
【②統計解析とグラフの自動作成】は、①の行程で作った表をそのまま統計解析ソフトにかけられるようにしてあります。
そして各種グラフを即座に作れるような雛形を各種用意してあります。
これら①と②については、いつか、映画『バック・トゥ・ザ・フューチャー』の冒頭出てくる、朝、ベッド脇に有る目覚まし時計のアラームを止めると、それに繋がれたトースターや玉子焼き機が自動で作動し朝食が完成というカラクリのように、1つの入力で多数の成果物が自動で出てくるような洗練したシステムにしたいと思っております。
【③オリジナルのチェック表】は、速報作成の各工程に於いて一切の先入観を捨てた状態のヒトの目で トリプルチェック(3回まわりの確認)をする時に、無駄なくスムーズに行えるチェック表です。
これら3つを駆使すれば量にもよりますが約14日で速報データをお出しできます。もっと早く速報が必要な場合は、なるべくご契約前にご相談ください。 10日以内も可能です。
月並みな方法で恐縮ですが、ご相談をいただきました時に予定表の空きがあれば、全て速報作りを入れ、努力と根性で更なる期間短縮を実現します。 その場合は特急料金がかかります事は、ご容赦いただきますようお願いします。
このように、機能食品研究所はメーカー様の「早く正確な結果を知りたい」というお気持ちに応えられるよう速報作成の技術を磨いております。
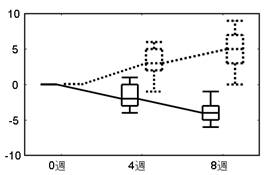
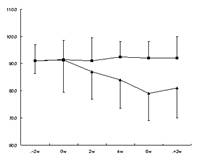
06-2.グラフ案
有意差検定を行い有効性・機能性の有無を確認します。
併せて主解析項目・副解析項目のグラフを作成し研究結果の全体像を把握します。
論文投稿や学会発表等で活用しやすいよう、より分かりやすいグラフのレイアウトになるよう工夫を重ねております。
仕様書や計画書を作成する時に、予めメーカー様に「何に使われますか?」「論文投稿用ですか?」「社内研修資料用ですか?」「何月何日までにグラフが欲しいというご要望はありませんか?」など伺い、こんな図を納品する事になりますねとお話を詰めておきます。
この時点で、メーカー様の研究・開発部署のかただけでなく営業のかたや広報のかたともお話を詰めさせていただく事が多いです。
例えば、アンケート結果をグラフ化したイメージをお伝えしますと、お客様側のイメージも広がるそうで「それならば、こういう形と色使いのグラフが良いな。」と、ご要望いただいたりと、着地点を思い浮かべたお話ができます。
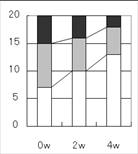
このように申しましても、その話をするのは仕様書や計画書の時点、つまり結果が出てくる何ヶ月前です。いざ結果が出てからグラフを作り始める時にはお客様側での使用用途が増える事もございます。
「やっぱり、カラーだけじゃ無くて白黒版も作って欲しい。」
「前は要らないって言ったけど、やっぱりグラフに吹きだしで『数値が有意に増加。つまり保湿性が増加。』のような説明を入れ込んで。」
「やっぱり、有意差マークと多重比較補正を考慮に入れたP値だけじゃなく、粗のP値の併記もお願いしたい。」
「縦1メートル、横2メートルのサイズでプリントする事にもなったから、線の太さと色の調節も頼んで良い?」
「円グラフで頼んだけど、帯状グラフに変更したい。」
「パワーポイント2007以降じゃなくて、2003以前で最適に表示できる方法でお願い。」
「印刷所に送るだけで良いようにイラストレータというソフトで入稿できないかな?」
・・・など、グラフ作りの前に言っていただけば、それを目指して作れば良いだけなので、大体のご要望にお応えできます。
そうなると、速報用に作って提出済みのグラフの作り直しはせねばなりませんが、それはお客様のお役に立つならばと速やかに対応いたします(内容によりましては追加費用がかかる時も有ります)。
このように、機能食品研究所はメーカー様の「試験結果を有効活用したい。」というお気持ちに応えられるよう、時には悩んだり一笑してもらったりしながらグラフ作りの技術を磨いております。
07.報告書作成
07-1.文章案作成
先ず報告書の文章案を弊社にて作成し、次に統括医と専門家による考察文章の作成となります。
論文投稿の際にこの報告書の文章を基として組み上げていく事が多いので、論文執筆をするような心がけのもと作成します。
報告書に入れる文章案の作成ですが、まず【目的】・【背景】・【材料と方法】・【実施施設】などを『計画書』から書き写します。
次にグラフの内容を、文章化して入れ込みます。
たとえば「空腹時血糖値の0週目に対する4週目の変化量では、群間に於いて被験物質群の有意な減少が認められた。P<0.01(P値0.0063)のように、事実を文章化したものを並べていきます。
その次が一番の肝となる「考察」をまとめる作業です。
ここでは、統括医の先生が作成されるお手伝いをさせていただきます。 計画書作成時にメーカー様と統括医の先生を交えた打合せをして決まりました「目的・意図」に沿って文章を構成します。
次に、試験を依頼してくださったメーカー様のご担当者様・関係者様に、意見・感想を聞いてまわります。 そうしますと「試験を計画した当時は、とりあえず測定しておきましょうという話だった測定項目で有効性が新発見できた件だけど。この事ついても、もっと重点を置いて書けませんかね?」など、色々と新たなご要望も出てきます。
このように試験の結果、出てきた有効性の有意差や傾向の数が多いと、どの項目に重点を置くかとか、文章構成の順番のご要望を数多くいただく事になります。
「そんなに色々な方々の意見・感想を聞いてまわって反映していては『船頭多くして船山に上る(指図する人が多いので,とんでもない方向に物事が進む。)』になり、まとまりのない文章になりません?」と言われる事もあります。
関わられた皆様の熱い気持ちを的確に反映できるのであれば、努力を惜しみません。 書き直しては読み返し、書き直しては読み返しの試行錯誤を重ね、試験報告書の文章案が完成します。
このように、機能食品研究所はメーカー様の求められている文章案を、試験結果として出てきた有効性の有意差や傾向の事実に沿いながら的確にご提供できる技術を磨いております。
07-2.報告書完成
グラフ案と文章案を練り上げ、報告書の完成となります。
製本物とデジタル媒体の両方で提出いたします。
グラフ案、文章案を用い、何度もメーカー様と統括医との打合せを行いましてから、いよいよ報告書は完成となります。
完成直前に改めて【配色】【文字の大きさ】【表のマス目の大きさ】【文章の言葉遣い】などを確認し、全体のバランスを見渡しながら調整をし、それから印刷いたします。
次に製本作業です。 プリントアウトしたものを、ページが透明袋になっている冊子に入れていきます。 重要な内容のページは見開きでパッと見る事ができ、それら以外は数枚ずつテーマ毎に束ねて1ページとしております。
お客様からは
「半年ぶりに見たとき、サッと重要点だけ把握できた。」
「部署内で回覧した時、即座に要点が分かると評判が良かったですよ。」
とお言葉をいただきました。
今の世の中はデジタル時代なので、プリントアウト物をお客様がコピー機にかけて複写ではありません。 よって製本物の冊子には「CD-R」「DVD-R」「USBメモリ」等のデジタルデータをお付けしています。 最近は光学ドライブが付いていないPCが増えてきたのでほとんどUSBメモリでの納品です。
このUSBですが、予備を含めて2セットお付けしております。
なぜ2セットかと言いますと、理由が有ります。
お客様が夜中にプリントアウトされる時、経年劣化等による破損のため読めないなんていう事故が発生しても、予備があれば安心では?と思ったからです。
今までお客様から「記録メディアが読めなくなった。」と言われた事が無いので杞憂かもしれません。
しかし、
将来、何かしらの時にお客様のお役に立つかもしれない
と思っていますので、2セットお付けするのは今後も続けます。
余談ですが、とあるお客様から
「深夜に仕事をしている時の話。その場に居ない同僚がCD-RをどのPCに入れっぱなしにして帰ったかが分からず大慌て。二十数台有るPCの電源を付けて、CDのトレイを開閉して調べるしか無いと途方に暮れた時に、そういえば予備が有ったと思い出し、助かりました。」
というお言葉をいただいた時、将来、何かしらの時にお役に立つかもという気持ちは無駄では無いと実感しました。
08.論文投稿
論文投稿や学会発表の原稿執筆やスライド・ポスター作成もお請けしております。
発表は原則として三重大学医学部・医学部附属病院の医師・教員との共著・連名となります。
■なぜ論文投稿をするのか
機能性表示食品を届け出る時に臨床試験結果を用いる場合は論文投稿が必須でございます。
論文投稿・学会発表に関する作業も機能食品研究所にてお請けしておりますので、いつでもご相談ください。
論文投稿や学会発表の大まかな流れは以下の通りです。投稿先や学会によって変わりますが、だいたいこんなものとご想像ください。
ご注意ください:その学会の会員でないと投稿や発表出来ない事が多いので投稿規定・発表規定を必ずご確認ください。機能性表示食品を届け出る時は査読付である事が必要なため、査読の有無についても投稿規定で確認が必要です。
■投稿・発表の流れ
●論文投稿の流れ
投稿先の雑誌・学会誌を探す
↓
原稿作成(要旨・目的・材料と方法・結果・考察・図・表など)
↓
原稿を投稿先に送る
↓
査読員や編集者による内容確認と修正必要箇所の指摘
↓
指摘された箇所の修正・掲載費用支払い
↓
掲載
●学会発表の流れ
発表する学会の総会を探す(開催日程と締切日に注意)
↓
応募(先ずは題名・要旨のみの場合が多いです)
↓
学会事務局での発表の可否選考
↓
学会の総会のプログラムパンフレット刷り上がり
↓
口頭発表の場合:学会が指定した分数以内で話せる枚数のスライドを作成し学会会場に持参 (10分間以内など)
ポスター発表の場合:学会が指定したサイズのポスターを作成し学会会場に持参(1.5mx1mサイズの紙など)
機能食品研究所、7つの特徴
機能食品研究所の臨床試験受託には7つの特徴が有ります。
1.第三者評価をする会社である機能食品研究所は、お客様の「正確な臨床試験データが欲しい」「良い結果を出すために試験計画立案の時点から親身になってサポートして欲しい」というお気持ちにお応えします。
お客様と弊社の二人三脚でゴールを目指します。
2.試験結果についての論文執筆・投稿・雑誌記事作成などもお請けしております。
お客様は「こうして欲しい」とご要望をしてくださるだけで良いのです。
3.何事も入念な準備が結果に大きな影響を与えます。
「初期値が綺麗に揃うと良いな」「この被験物質の効き目が出やすい方々で集めたいな」というご期待に応えます。
4.同じ道具・機械・用具を使っても測定者の違いによる誤差が生じます。
その問題を解決するためのノウハウと熟練の技術が有ります。
5.商品の開発をされている方の「早く結果を知りたい」というお気持ちに応えます。
試験完了から数日以内の速報提出も可能です。
6.お客様が自社で測定されると、機器数や測定内容の項目数が多い場合、精度管理が更に大変です。
専門業者である弊社なら項目数17の実績が有ります。
7.項目数が多い場合、5分で1名の測定をしたとしても1日に100名を超えるデータを取得するのに8時間以上かかってしまいます。
弊社では項目数に関わらず精度を保ちながら150名の測定も可能です。
最後までお読みいただき、ありがとうございました。
ご不明な点や費用等のご質問等ございましたら、先ずはお気軽にご連絡ください。
(株)機能食品研究所
TEL:059-253-8091
E-mail:info@ksk-lab.co.jp
本社:〒514-0027三重県津市大門7-15
津センターパレス4F
研究室:〒514-8507津市栗真町屋町1577
三重大学 総合研究棟2 A棟4F
![]()




